Trichlorfluorsilan
aus Wikipedia, der freien Enzyklopädie
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
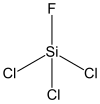
| |||||||
| Allgemeines | |||||||
| Name | Trichlorfluorsilan | ||||||
| Andere Namen |
Siliciumtrichloridfluorid | ||||||
| Summenformel | SiCl3F | ||||||
| Kurzbeschreibung |
farbloses Gas[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 153,43 g·mol−1 | ||||||
| Aggregatzustand |
gasförmig[1] | ||||||
| Schmelzpunkt | |||||||
| Siedepunkt |
12 °C[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Trichlorfluorsilan ist eine anorganische chemische Verbindung des Siliciums aus der Gruppe der Siliciumtetrahalogenide.
Gewinnung und Darstellung
Trichlorfluorsilan (wie auch andere Fluorchlorsilane) kann durch Reaktion von Natriumhexafluorosilicat und Aluminiumchlorid oder durch Halogenaustausch in Siliciumtetrachlorid mit Antimon(III)-fluorid und Antimon(V)-chlorid als Katalysator gewonnen werden.[1]
Eigenschaften
Trichlorfluorsilan ist ein farbloses, sehr hydrolyseempfindliches Gas.[1]
Verwendung
Trichlorfluorsilan kann in der Halbleiterindustrie zur Abscheidung von Siliciumschichten verwendet werden.[3]
Einzelnachweise
- ↑ a b c d e f Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 679.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Google Patente: Patent US7030260 - Preparation of mixed-halogen halo-silanes, abgerufen am 5. Januar 2014.