Evolution
Unter Evolution (von lateinisch evolvere „herausrollen“, „auswickeln“, „entwickeln“) versteht man im deutschsprachigen Raum in erster Linie die biologische Evolution. Darunter wird die von Generation zu Generation stattfindende allmähliche Veränderung der vererbbaren Merkmale einer Population von Lebewesen und von anderen organischen Strukturen (z. B. Viren) verstanden. Das Lehr- und Forschungsgebiet der Evolution wird als Evolutionsbiologie bezeichnet und unterliegt, wie viele andere Wissenschaften, einem kontinuierlichen Erkenntnisfortschritt. Hierzu können insbesondere neue Einsichten durch die Entdeckung neuer Fossilien oder die Anwendung neuer Forschungsmethoden beitragen. Das Themenfeld der Evolution wurde zuweilen unterteilt in die Evolutionsgeschichte, in der die Veränderungen der Lebewesen im Laufe der Erdgeschichte beschrieben werden und bei dem es Überlappungen mit der Paläontologie gibt, sowie in die Evolutionstheorie, die naturwissenschaftliche Erklärungen (Hypothesen und Theorien) für das Gesamtphänomen der Evolution entwickelt. Die beiden Ansätze sind heutzutage in der Wissenschaft innig miteinander verwoben und befruchten sich wechselseitig. Wissenschaftler beschäftigen sich ebenfalls im Rahmen der theoretischen Biologie mit der biologischen Evolution. Die theoretische Biologie als interdisziplinäres Teilgebiet der Biologie entwickelt mathematische Modelle und führt statistische Hypothesentests und Laborexperimente durch, um den Erkenntnisgewinn zu fördern.
Geschichte
Die Merkmale der Lebewesen sind in Form von Genen codiert, die bei der Fortpflanzung kopiert und an die Nachkommen weitergegeben werden. Durch Mutationen entstehen unterschiedliche Varianten (Allele) dieser Gene, die zur Entstehung veränderter oder neuer Merkmale führen können. Diese Varianten sowie Rekombinationen führen zu erblich bedingten Unterschieden in Form der genetischen Variabilität zwischen Individuen. Evolution findet statt, wenn sich die Häufigkeit bestimmter Allele in einer Population (die Allelfrequenz im Genpool) ändert und die entsprechenden Merkmale in der Population dadurch seltener oder häufiger werden. Dies geschieht entweder durch natürliche Selektion (unterschiedliche Überlebens- und Reproduktionsrate aufgrund dieser Merkmale), durch sexuelle Selektion oder zufällig durch Gendrift.
Der entscheidende Bruch mit dem früheren Konzept konstanter typologischer Klassen oder Typen der Biologie kam mit der Theorie der Evolution durch natürliche Selektion, die von Charles Darwin und Alfred Russel Wallace in Form von im Laufe der Zeit veränderlichen Populationen formuliert wurde. Diese Bedeutung der Variabilität und der durch natürliche Selektion in Gang gehaltene Prozess bei Lebewesen wurden dann erstmals ausführlich und fundiert von Charles Darwin in seinem 1859 erschienenen Buch The Origin of Species dargestellt. Um 1900 wurden die Prinzipien der Vererbung bekannt (da die früheren Untersuchungen von Gregor Mendel nicht weiter beachtet worden waren) und um 1910 die Bedeutung der Chromosomen. Dadurch schienen sich die Konzepte des Darwinismus, der die Veränderungen hervorhob, und der Genetik, die die statische Weitergabe von Merkmalen lehrte, einander zu widersprechen. Erst ab den 1930er Jahren konnten die Selektionsprozesse mit den mendelschen Regeln zur Vererbung in Übereinklang gebracht werden, woraus sich die Synthetische Theorie der Evolution entwickelte. Sie definierte Evolution als die zeitliche Änderung der relativen Allelhäufigkeiten (Allelfrequenzen) in einer Population.[2] Durch ihre deskriptiven und kausalen Aussagen wurde diese Theorie zum zentralen organisierenden Prinzip der modernen Biologie und lieferte eine fundierte Erklärung für die Entstehung der Vielfalt des Lebens auf der Erde.
1944 lieferten die Arbeiten von Oswald Avery und seinen Kollegen ein starkes Indiz dafür, dass DNA der Träger genetischer Informationen ist, denn bislang hatte man eher Proteine „im Verdacht“, entsprechende Informationen zu beherbergen. Zusammen mit der Entschlüsselung der Struktur der DNA durch Rosalind Franklin, James Watson und Francis Crick im Jahr 1953 wurde die physische Basis der Vererbung geklärt. Seitdem ist auch die molekulare Genetik ein zentraler Bestandteil der Evolutionsbiologie.[3]
Grundlagen
Vererbung
Gregor Mendel zeigte anhand von Erbsen, dass Vererbung in eng definierten (diskreten) Einheiten erfolgt, indem Merkmale von der Elterngeneration an die Nachkommen vererbt werden, und dass diese Merkmale diskret sind: Wenn ein Elternteil runde und der andere faltige Erbsen hatte, dann zeigte der Nachwuchs nicht ein Gemisch, sondern entweder runde oder faltige Erbsen. Mendel wies außerdem nach, dass die Merkmale der Eltern in einer genau definierten und vorhersagbaren Weise an die Nachkommen vererbt wurden, nämlich nach den mendelschen Regeln. Seine Forschungen waren die Basis für das Konzept der diskreten, erblichen Merkmale, der Gene.[4] Mendels Arbeiten beantworteten die lange offene Frage, warum Merkmalsvarianten in Populationen stabil bleiben. Im Nachhinein muss man feststellen, dass es ein großer Zufall war, dass er lauter diskrete Merkmale gewählt hatte, denn bei vielen anderen Merkmalen (etwa bezüglich der erreichten Pflanzenhöhe) wären komplexere genetische und auch umweltbedingte Einflüsse aufgetreten.
Spätere Forschungen enthüllten die physische Basis der Gene und identifizierten die DNA als das genetische Material. Gene wurden neu definiert als spezifische Regionen der DNA. DNA wird von Lebewesen als Chromosomen gelagert. Ein bestimmter Ort auf einem Chromosom wird als Genlocus (oder kurz Locus) bezeichnet, die Variante einer DNA-Sequenz auf einem bestimmten Locus bezeichnet man als Allel. Die Kopie der DNA erfolgt nicht perfekt und Änderungen (Mutationen) der Gene produzieren neue Allele und beeinflussen daher die Merkmale, die von diesen Genen kontrolliert werden. Diese einfache Beziehung zwischen einem Gen und einem Merkmal liegt in vielen Fällen vor, komplexe Merkmale, zum Beispiel die Widerstandsfähigkeit gegen Krankheiten, werden jedoch von vielen zusammenwirkenden Genen („polygen“) kontrolliert.[5]
Genetische Variabilität
Die genetische Variabilität oder Variation resultiert aus Mutationen der DNA, der Wanderung von Individuen zwischen Populationen (dem Genfluss), und der Durchmischung von Genen bei der sexuellen Fortpflanzung (Rekombination). Bei einigen Lebensformen, wie Bakterien und Pflanzen, wird Variabilität auch durch die Mischung des genetischen Materials zwischen Arten durch horizontalen Genfluss und Hybridisierung erzeugt.[6][7] Trotz all dieser Variabilität verursachenden Prozesse sind die meisten Bereiche der DNA einer Art (das Genom) bei allen Individuen einer Art identisch.[8] Vergleichsweise kleine Änderungen des Genotyps (des Merkmale codierenden Teiles des Genoms), können jedoch erhebliche Auswirkungen auf den Phänotyp (die Gesamtheit der genetisch bedingten Merkmale eines Individuums; vereinfacht ausgedrückt, auf das genetisch bedingte äußere Erscheinungsbild) haben. Zum Beispiel beträgt der Unterschied der DNA-Sequenzen von Schimpanse und Mensch nur fünf Prozent.[9][10]
Der Phänotyp resultiert aus der Interaktion seiner individuellen genetischen Ausstattung, seines Genotyps, mit der Umwelt. Die Variabilität der vererbbaren Merkmale innerhalb einer Population reflektiert also die Variabilität des Genoms innerhalb dieser Population. Die Frequenz einzelner Merkmalsvarianten kann in einer Population schwanken und in Relation zu anderen Allelen des Gens größer oder kleiner werden. Alle evolutionär wirksamen Kräfte agieren, indem sie diese Änderungen der Allelfrequenzen in die eine oder andere Richtung fördern. Die Variabilität eines Merkmals verschwindet, wenn ein Allel eine feste Frequenz erreicht, wenn es also entweder aus der Population verschwindet oder wenn es alle anderen, früher vorhandenen Allele ersetzt hat.[11]
Homologie
Organe der Säugetiere wie Wirbelsäule, Augen, Verdauungskanal, Lungen ähneln denen anderer Wirbeltiere. Diese Gemeinsamkeiten basieren auf der Abstammung von gemeinsamen Vorfahren. Diese Ähnlichkeiten werden in der Biologie als Homologie bezeichnet. Fossile Skelettfunde bieten die Möglichkeit, Homologien zu erkennen und dadurch Hinweise auf eine gemeinsame Abstammung zu erlangen. Im Verlauf der Evolution haben viele Organismen ihre Lebensweise verändert. Durch genetische Variabilität und natürliche Auslese fand ein Funktionswandel von Organen statt. Dadurch kam es zu einer Angepasstheit des Baues an die jeweilige Funktion.
Analogie
Analoge Organe weisen verschiedenen Grundbaupläne auf, dennoch besitzen sie Ähnlichkeiten, die von ihrer Abstammung unabhängig sind. Der Grund dafür ist die Anpassung an gleiche Funktionen. Ein Beispiel dafür ist die Grabhand des Maulwurfs und die Grabschaufeln der Maulwurfsgrille, denn sie sind sich sehr ähnlich. Während die Hand des Maulwurfs ein Knochenskelett aufweist, liegt bei der Maulwurfsgrille ein Außenskelett aus Chitin vor. Maulwurf und Maulwurfsgrille besitzen unterschiedliche Baupläne ihrer äußerlich ähnlichen Gliedmaßen. Analoge Ähnlichkeiten sind stammesgeschichtlich unabhängig voneinander, lassen jedoch Rückschlüsse auf ähnliche Umweltbedingungen und Lebensweisen zu.
Evolutionsfaktoren
Als Evolutionsfaktoren bezeichnet man in der Biologie Prozesse, durch die der Genpool (die Gesamtheit aller Genvariationen in einer Population) verändert wird. Dies erfolgt überwiegend durch Veränderungen der Allelfrequenzen im Genpool der Population. Diese Prozesse sind die zentrale Ursache für evolutionäre Veränderungen.
Die wesentlichen Evolutionsfaktoren, die den Genpool (Gesamtheit aller Genvarianten in einer Population) verändern, sind Mutation, Rekombination, Selektion und Gendrift.
Mutation
Mutationen können im Körper an irgendeiner Stelle außerhalb der Keimbahn, also außerhalb von Fortpflanzungszellen, auftreten und heißen dann somatische Mutation. Diese haben, im Gegensatz zu den Keimbahnmutationen, keinen direkten Einfluss auf die nachfolgenden Generationen, höchstens indirekt, wenn die somatische Mutation die Fitness des Trägerorganismus beeinträchtigt und dadurch die Weitergabewahrscheinlichkeit der eigenen Gene statistisch reduziert ist. Keimbahnmutationen sind Mutationen, die an die Nachkommen über die Keimbahn vererbt werden können; sie betreffen Eizellen oder Spermien sowie deren Vorläufer vor und während der Oogenese bzw. Spermatogenese. Auf den Trägerorganismus, in dem sie stattfinden, haben sie normalerweise keinen Einfluss.
Mutationen und ihre Wirkungen sind feststellbar: So kann zum Beispiel die Entstehung neuartiger Enzyme in Mikroorganismen aufgrund der kürzeren Generationszeit im Zeitraffer beobachtet werden. Beispiele für neu entstandene Enzyme sind die Nylonasen.
Rekombination
Rekombinationen sind Neuanordnungen von bestehenden Genen. Sie können im Rahmen der vermutlich phylogenetisch älteren parasexuellen Rekombination (bei Prokaryoten und einigen Pilzen) auftreten, aber auch im Rahmen der sexuellen Fortpflanzung. Bei letzterer, die typisch für fast alle Pflanzen und Tiere ist, unterscheidet man die Intrachromosomale Rekombination durch Neukombination von Allelen innerhalb von Chromosomen (als Folge des Crossing-overs anlässlich der 1. Reifeteilung) und die Interchromosomale Rekombination durch Neukombination ganzer Chromosomen im Chromosomensatz.
Selektion
Selektion tritt auf, wenn Individuen mit für das Überleben und die Fortpflanzung vorteilhaften Merkmalen mehr Nachwuchs produzieren können als Individuen ohne diese Merkmale. Auf diese Weise können für die Population im Laufe der Generationen insgesamt verbesserte Anpassungen an die Umweltbedingungen entstehen. Im Rahmen solcher Merkmalsänderungen kann sich eine Art auch im Rahmen der Artbildung in neue Arten aufspalten. Die „normale“ Selektion läuft zwischen Individuen unterschiedlicher Spezies ab und wird auch als natürliche Selektion bezeichnet. Ein Sonderfall ist die durch den Menschen eingesetzte „künstliche Selektion“ oder Zucht, die beispielsweise für die zahlreichen Hunderassen verantwortlich ist. Sobald Haushunde in der freien Wildbahn überleben müssen, was in vielen Ländern der Erde ein verbreitetes Phänomen ist, setzen sich durch natürliche Selektion bald nur bestimmte Genotypen durch. Die Hunde werden relativ einheitlich in der Größe, in Farbcharakteristiken und im Verhalten, da sich die „extremeren“ angezüchteten Eigenschaften in natürlicher Umgebung als nachteilig erweisen und die entsprechenden Hunde zu geringerem Fortpflanzungserfolg kommen lassen.
Ein Spezialfall der Selektion bzw. der natürlichen Selektion ist die sexuelle Selektion, die intraspezifisch (also innerhalb einer Art) wirkt: Die Selektion auf Merkmale, deren Präsenz direkt mit dem Kopulationserfolg durch bevorzugte Partnerwahl korreliert ist.[12] Durch sexuelle Selektion evolvierte Merkmale sind besonders bei den Männchen von Tieren verbreitet. Obwohl diese Merkmale die Überlebenswahrscheinlichkeit einzelner Männchen reduzieren können (z. B. durch behindernde Geweihe, durch Paarungsrufe oder leuchtende Farben), ist der Reproduktionserfolg solcher Männchen im Normalfall höher.[13]
Helfersysteme und Eusozialität stellen weitere Spezialfälle dar: Bei mehr als 200 Vogelarten und etwa 120 Säugerarten findet man soziale Strukturen, bei denen ein Teil der Individuen zumindest zeitweise auf eine eigene Reproduktion verzichtet und stattdessen Artgenossen bei deren Reproduktion unterstützt. Dies steht in scheinbarem Widerspruch zu Darwins Thesen. Untersuchungen dieser Helfersysteme haben jedoch gezeigt, dass diese Hilfe meist umso stärker erfolgt, je näher die Helfer mit dem aufzuziehenden Nachwuchs verwandt sind.[14] Da ein Teil des Genoms von Helfer und aufgezogenem Fremdnachwuchs identisch ist, erreicht der Helfer also trotz Verzicht auf eigene Reproduktion eine Weitergabe eines Teils seines Genoms. Da die Selektion hier nicht mehr auf der Ebene des Phänotyps, sondern des Genotyps ansetzt, hat Richard Dawkins für diese und ähnliche Fälle den Begriff des „egoistischen Gens“ geprägt.[15] Bei eusozialen Insekten wie beispielsweise Ameisen und Sozialen Faltenwespen verzichtet der größte Teil der Weibchen lebenslang auf eine eigene Fortpflanzung. Eusozialität ist für diese Weibchen nicht mit einer verringerten evolutionären Fitness verbunden, da sie aufgrund einer genetischen Besonderheit (Haplodiploidie) mit ihren Schwestern näher verwandt sind als mit potentiellen eigenen Nachkommen. Bei der Aufzucht von Schwestern geben sie also einen größeren Teil ihres Genoms weiter als bei der Aufzucht eigener Töchter.[16]
Gendrift
Gendrift ist die Änderung von Allelfrequenzen von einer Generation zur nächsten, die geschieht, weil die Allele einer Generation von Nachkommen statistisch gesehen eine Zufallsstichprobe der Allele der Elterngeneration darstellen und deren Auswahl daher auch einem Zufallsfehler unterliegt. Selbst wenn keine Selektion stattfindet, tendieren Allelfrequenzen dazu, im Verlauf der Zeit größer oder kleiner zu werden, bis sie schließlich die Werte 0 % oder 100 % erreichen („Fixierung“ des Allels). Schwankungen der Allelfrequenzen in aufeinanderfolgenden Generationen können daher durch reinen Zufall dazu führen, dass einzelne Allele aus der Population verschwinden. Zwei getrennte Populationen mit anfänglich gleichen Allelfrequenzen können daher durch zufällige Schwankungen in zwei unterschiedliche Populationen mit einem unterschiedlichen Satz von Allelen auseinanderdriften.[17]
Ob natürliche Selektion oder Gendrift den größeren Einfluss auf das Schicksal neuer Mutationen haben, hängt von der Größe der Population und der Stärke der Selektion ab.[18] Natürliche Selektion dominiert in großen Populationen, Gendrift in kleinen. Schließlich hängt die Zeit, die ein Allel benötigt, um in einer Population durch Gendrift eine feste Frequenz zu erreichen (bis also 0 % oder 100 % der Individuen der Population das Allel tragen), von der Populationsgröße ab; bei kleineren Populationen geschieht dies schneller.[19]
Die Größe einer Population (genauer die effektive Populationsgröße) hat daher einen großen Einfluss auf den Verlauf der Evolution. Wenn eine Population beispielsweise durch einen genetischen Flaschenhals (eine vorübergehend sehr niedrige Populationsgröße) geht, verliert sie damit auch einen großen Teil ihrer genetischen Variabilität. Die Population wird insgesamt gleichartiger und verliert viele seltene Varianten. Solche „Flaschenhälse“ können durch Katastrophenereignisse, Klimaschwankungen, durch Wanderungen oder Teilung von Populationen sowie natürlich durch einen anthropogenen Belastungsdruck verursacht werden.
Entwicklung biologischer Komplexität
Ein wichtiges Ergebnis des Evolutionsprozesses ist die Entwicklung biologischer Komplexität.[20] Die Evolution hat einige bemerkenswert komplexe Organismen hervorgebracht. Allerdings ist ein numerischer Grad der Komplexität in der Biologie sehr schwer zu definieren oder zu messen. Als mögliche Messgrößen wurden beispielsweise Eigenschaften wie der Genomgröße, Anzahl der Gene, Anzahl der Zelltypen oder die Morphologie vorgeschlagen.[21][22][23]
Normalerweise haben Organismen, die eine höhere Reproduktionsrate als ihre Konkurrenten haben, einen evolutionären Vorteil. Um sich schneller vermehren und mehr Nachkommen produzieren zu können, können sich Organismen in Richtung größerer Einfachheit entwickeln, da sie dann weniger Ressourcen zur Fortpflanzung benötigen. Ein gutes Beispiel sind Parasiten wie der Malariaerreger Plasmodium und Mykoplasmen – diese Organismen verzichten auf Eigenschaften, die durch den Parasitismus überflüssig geworden sind.[24]
Eine Abstammungslinie kann auch Komplexität einbüßen, wenn ein bestimmtes komplexes Merkmal in der Umgebung einfach keinen Selektionsvorteil bietet. Selbst wenn der Verlust dieses Merkmals keinen Selektionsvorteil bedeutet, kann durch das Merkmal durch eine Anhäufung von Mutationen verloren gehen, wenn diese neutral sind (keinen unmittelbaren Selektionsnachteil bedeuten).[25]
Gäbe es in der Evolution (wie im 19. Jahrhundert weithin angenommen) einen aktiven Trend zur Komplexität (Orthogenese),[26] dann wären zu erwarten, dass der häufigste Wert (der Modus) der Komplexität unter den Organismen im Laufe der Zeit aktiv zunimmt.[27]
Eine Zunahme der Komplexität kann aber auch durch einen passiven Prozess erklärt werden: Unter der Annahme,
- dass sich die Komplexität rein zufällig ändert (ohne im teleologischen Sinn eine bestimmte Richtung zu bevorzugen) und
- dass es eine Mindestkomplexität gibt,
nimmt die durchschnittliche Komplexität der Biosphäre im Laufe der Zeit zu. Dies beinhaltet eine Zunahme der Varianz, aber der Modus ändert sich nicht.[27] Es gibt dann zwar auch eine Tendenz, dass im Laufe der Zeit einige Organismen mit immer höherer Komplexität entstehen, dies betrifft aber einen immer kleineren Prozentsatz der Lebewesen.[23] Einige wenige Lebewesen entwickeln sich gelegentlich nach rechts und verlängern so den rechten „Schwanz“ in der Komplexitätsverteilung. Einige bewegen sich auch nach links, stoßen aber ganz links schließlich an eine Grenze, die durch Minimalanforderungen des Lebens (siehe etwa Minimalgenom) gegeben ist.[28][29]
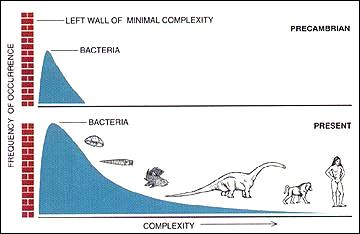
Im passiven Fall ist jeder Anschein einer Evolution, die von sich aus (aktiv/teleologisch) zu immer komplexeren Organismen führt, darauf zurückzuführen, dass sich die Wahrnehmung des Menschen auf die wenigen großen, komplexen Organismen am rechten Ende der Komplexitätsverteilung (den Menschen selbst und andere „höhere“ Tiere und Pflanzen) konzentrieren und einfachere und viel häufigere Organismen ignorieren (vgl. Mikrobielle Dunkle Materie) – außer natürlich in der Frühzeit der Erde, als es nur Lebewesen mit einfacher Organisation gab. Das passive Modell sagt voraus, dass die Mehrheit der Arten mikroskopische Prokaryoten sind, was durch Schätzungen von 106 bis 109 rezenten Prokaryotenspezies[30] im Vergleich zu Diversitätsschätzungen von 106 bis 3·106 für die Eukaryoten (komplex-zellulären Organismen: Protisten, Pflanzen, Pilz und Tiere – inkl. dem Menschen)[31][32] bestätigt wird. Die Prokaryoten (Bakterien und Archaeen) sind bis heute am häufigsten und erfolgreichsten geblieben, und der Modus hat seine bei diesen Organismen gelegene Position nicht mehr verändert.[28][29][23]
Die von Stephen J. Gould et al. zunächst nur für zelluläre Organismen dargestellte Verteilung lässt sich im Übrigen auf der linken Seite noch ein Stück fortsetzen, indem man auch Viren in Betracht zieht. Die minimale Organisationsgröße („linke Mauer“) der Viren ist noch um einiges geringer als die der zellulären Organismen. Dies geschieht aber unter Preisgabe der Unabhängigkeit von Wirtsorganismen. Wichtig ist, dass die zu erwartende Vielfalt in diesem Bereich nochmals größer ist als bei den Prokaryoten. Der Modus der Verteilung verschiebt sich weiter nach links.[33]
Rekonstruktion des Evolutionsablaufs
Die rekonstruierbaren Abläufe der irdischen Evolution – die Richtungen, die sie einschlug und die zeitlichen Einordnungen – sind auf Basis des Fossilberichts sowie der Analyse rezenter Muster und Prozesse rekonstruierbar. Die ehemals abgelaufenen Prozesse bezüglich Richtung, zeitlicher Einordnung und Evolutionsgeschwindigkeit sind umso sicherer rekonstruierbar, je mehr unabhängige Indizien beitragen können, das historische Geschehen zu erhellen. Grundsätzlich wird vom Aktualismus für den Ablauf geologischer und biologischer Prozesse der Vergangenheit ausgegangen, das heißt von der Annahme, dass die biologischen, ökologischen und geologischen Prozesse in der Vergangenheit nach den gleichen oder ähnlichen Prinzipien abgelaufen sind, wie sie heute beobachtet und gemessen werden können. Hierzu können auch Experimente durchgeführt werden, die bis zu einem gewissen Grad auf Prozesse in der Vergangenheit projiziert werden können.
Bei Formen, die keine oder fast keine Fossilien hinterlassen haben, wozu fast alle Prokaryoten sowie die Mehrzahl der eukaryotischen Einzeller gehören, daneben auch alle skelettfreien sonstigen Organismen, wie Würmer, Quallen, Nacktschnecken usw., können meist nur Vergleiche aus der rezenten (heutigen) Fauna oder Flora angestellt werden bei gleichzeitiger kritischer Plausibilitätsprüfung der daraus abgeleiteten Schlussfolgerungen. Hier werden die Rekonstruktionen der zurückliegenden Abläufe vor allem auf Basis der molekularen Ähnlichkeit nach dem Analyseverfahren der phylogenetischen Verwandtschaft vorgenommen. Das Prinzip der molekularen Uhr kann helfen, die Abzweigungspunkte der verschiedenen Verwandtschaftslinien (Kladen) ungefähr zu datieren. Auch Prozesse der Koevolution, beispielsweise die ehemalige Aufnahme von Bakterien in Archaeen-Zellen, die dort (vor vielleicht zwei Milliarden Jahren, Abschätzung schwierig) zu den Mitochondrien und zu den Chloroplasten als Endosymbionten einer eukaryotischen Zelle geworden sind, können praktisch nur aus rezenten Daten über molekulargenetische Ähnlichkeiten sowie Ähnlichkeiten im Stoffwechsel und in der Struktur der Endosymbionten erschlossen werden.
Am häufigsten sind skeletttragende Meeresformen als Fossilien zu finden, deutlich seltener Arten aus dem Festland von Binnengewässern (Flüssen, Seen). Sehr wenige Fossilien hat man üblicherweise aus Gebirgsregionen, aus Moor- und Quellgewässern sowie auch generell aus ehemaligen Trockenzonen der Erde, da eine Einbettung und ein Erhalt an solchen Stellen generell eher unwahrscheinlich ist.
Fossile Überlieferung

Hinweise auf den zeitlichen Rahmen der Evolutionsabläufe geben die Fossilien, die morphologisch untersucht werden können, aus denen aber vielfach auch biologisch-ökologische Eigenschaften, wie die besiedelten Lebensräume, Bewegungsweisen oder manchmal sogar das Sozialverhalten (z. B. wenn sie in Rudeln bzw. Schwärmen auftreten) ablesbar sein kann. Entsprechend der vertikalen Aufeinanderfolge fossilführender Gesteinsschichten lassen sich Gemeinschaften fossiler Lebewesen gemäß dem (Prinzip der Stratigraphie) in eine zeitliche Reihenfolge bringen. Während dies zunächst nur Informationen über das „relative Alter“ erbringt (welche Fossilien waren früher, welche später?), lässt sich mit Hilfe geeigneter radiometrischer Methoden in den Gesteinen und/oder den darin enthaltenen Fossilien eine Absolutdatierung vornehmen (Geochronologie).
Das Alter der Fossilien gibt Auskunft darüber, wann im Verlauf der Stammesgeschichte einzelner Gruppen sowie der Lebewesen insgesamt bestimmte Innovationen und Aufspaltungsereignisse (adaptive Radiationen) auftraten. Durch datierbare Fossilfunde ist zum Beispiel bekannt, dass (bis auf wenige Ausnahmen wie z. B. Cloudina)[34] alle Gruppen skeletttragender Tiere in einem engen Zeitfenster im frühen bis mittleren Kambrium vor etwa 540 bis 500 Millionen Jahren erstmals auftraten.[35] Wie weit dies durch biologische Innovationen hervorgerufen wurde oder wie weit sich die Umweltbedingungen derart änderten, dass nunmehr Skelettbildungen und -ablagerungen chemisch-physikalisch möglich wurden, ist weiterhin eine nicht abschließend geklärte Frage.
Fossile Übergangsformen (Mosaikformen und Missing Links) sind ein von Untersuchungen an rezenten Lebewesen unabhängiger Beweis für die Verwandtschaft zwischen systematischen Großgruppen. Berühmte Beispiele dafür sind „gefiederte Dinosaurier“, Archaeopteryx und die Vögel der Jehol-Gruppe als Übergangsformen von den nicht fliegenden Amnioten (umgangssprachlich „Reptilien“ bzw. – klassische – „Dinosaurier“, korrekt „Nicht-Vogel-Dinosaurier“ genannt, beides paraphyletische Einheiten) und den modernen Vögeln[36] sowie Panderichthys, Tiktaalik und Ichthyostega als Übergangsformen zwischen Knochenfischen und Landwirbeltieren.[37] Im günstigsten Fall ist der Übergang zwischen der ursprünglichen und der daraus abgeleiteten Gruppe durch eine Abfolge von Fossilfunden belegt, die mit abnehmendem Alter der neuen Gruppe morphologisch immer ähnlicher werden.
Evolutionäre Trends sind in vielen Fällen innerhalb systematischer Gruppen gut dokumentiert, so z. B. bei den pferdeartigen Säugetieren: Aus vielzehigen, fuchsgroßen, laubfressenden Formen im Alttertiär sind über mehrere Zwischenstufen die heutigen Pferde hervorgegangen.
Schließlich dokumentiert die fossile Überlieferung Ab- und Zunahmen in der Diversität systematischer Gruppen. Faunenschnitte sind Massenaussterben, bei denen in geologisch gesehen kurzen Zeiträumen die Zahl fossil überlieferter Taxa stark reduziert wurde und manche Großgruppen völlig verschwanden oder in ihrer Vielfalt stark abnahmen. Bekanntester, wenngleich nicht größter Faunenschnitt ist das weitgehende Aussterben der „Dinosaurier“ (mit Ausnahme der Gruppe der Vögel) und weiterer Großgruppen am Ende der Kreidezeit. Die freigewordenen ökologischen Nischen konnten in der Folgezeit im Rahmen einer Radiation durch die Säugetiere und die modernen Vögel eingenommen werden.
Ein Überblick über das Auftreten der Tier- und Pflanzenstämme wird unter Evolutionsgeschichte präsentiert.
Phylogenetische Systematik
Der Merkmalsvergleich der Organismen im Rahmen der biologischen Systematik zeigte, dass die Merkmale nicht in beliebigen Kombinationen auftreten, sondern in einem System abgestufter Ähnlichkeiten. Dabei lassen sich Merkmalsgruppen gegeneinander abgrenzen, anhand derer die rezenten Organismen in Gruppen (Taxa, Einzahl Taxon), zusammengefasst (klassifiziert) und hierarchisch geordnet werden können.

Dass dies möglich ist, wurde von Darwin als starkes Indiz für eine gemeinsame Abstammung aller Lebewesen gewertet. Damit diese Gruppierungen (Systematisierungen) die tatsächlichen Verwandtschaftsverhältnisse wiedergeben (phylogenetische Systematik), wurde als zentrales Kriterium die Homologie von Merkmalen eingeführt, das heißt, dass die Ähnlichkeit nur dann einen Aussagewert hat, wenn die entsprechenden Merkmale oder Organe auf die gleichen ursprünglichen Merkmale zurückzuführen sind. Die teilweise durch ihre Sukkulenz ähnlich aussehenden Kakteen Amerikas und Wolfsmilchgewächse Afrikas zeigen analoge Bildungen. Ihre oft ähnliche Erscheinungsform ist kein Hinweis auf eine engere Verwandtschaft und Abstammung von einem gemeinsamen Vorfahren.
Ein Sonderfall homologer Merkmale sind morphologische Merkmale oder sogar Verhaltensweisen, die für ihre heutigen Träger keinen erkennbaren Zweck mehr erfüllen (Rudimente), beispielsweise die Reste des Hinterbeinskeletts bei Riesenschlangen und Walen. In beiden Fällen weisen diese Rudimente auf die Abstammung von vierbeinigen Tieren (Echsen bzw. Paarhufern) hin.
Reste früherer funktionierender Gene, die heute offensichtlich funktionslos sind, findet man im Genom beispielsweise bei manchen Pseudogenen.
Vergleichende Biogeographie
Die Verbreitung von Taxa liefert in vielen Fällen Hinweise für evolutionäre Entwicklungen. Viele Taxa haben geografische Verbreitungen, die allein durch die heutigen lokalen ökologischen Verhältnisse oder Anpassungen nicht zu erklären sind. Dies gilt insbesondere für Endemiten. Ein bekanntes Beispiel für Reliktendemiten sind die Lemuren, ein Taxon innerhalb der Feuchtnasenaffen. Lemuren waren im Tertiär in Nordamerika und Eurasien weit verbreitet, sind heute aber auf Madagaskar endemisch. Sie wurden von den später evolvierten und offensichtlich konkurrenzstärkeren Trockennasenaffen (Haplorhini) überall verdrängt und konnten sich nur auf Madagaskar halten, das aufgrund einer zwischenzeitlich erfolgten geographischen Isolation von Trockennasenaffen nicht besiedelt werden konnte.
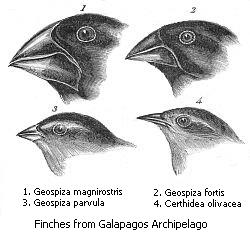
Ebenso wichtig für die Evolutionsbiologie sind Entstehungsendemiten. Berühmtestes Beispiel sind hier die Darwinfinken (Familie Emberizidae) auf den Galapagosinseln, 965 km vor der Küste Ecuadors. Auf der Inselgruppe vulkanischen Ursprungs, deren älteste Insel vor fünf bis zehn Millionen Jahren entstand, entwickelten sich aus einer vom Festland verdrifteten Vorgängerart durch adaptive Radiation 14 verschiedene Arten in drei Gattungen. Dabei änderten sich vor allem die Schnabelform, das Federkleid und die Größe der Vögel. Charles Darwin sammelte die unterschiedlichen Arten 1836 auf seiner Weltreise.
Vergleichende Embryonalentwicklung
Karl Ernst von Baer hat als erster erkannt, dass frühe Entwicklungsstadien verwandter Organismen einander ähnlicher sind als die ausgewachsenen Individuen. Ernst Haeckel formulierte auf Basis dieser Erkenntnisse, dass die Ontogenese die Evolution (Phylogenese) eines Lebewesens rekapituliert (Biogenetische Grundregel). Diese Regel wird heute jedoch als zu starke Vereinfachung betrachtet. Wiederholt werden nicht die Adultstadien, sondern die frühen Embryonalstadien der jeweiligen Vorformen einer Art. Das kann dadurch erklärt werden, dass evolutionäre Neuentwicklungen immer auf bestehende Arten und damit auf bestehende Organsysteme aufbauen. Daher schließt die Entwicklung (die Ontogenese) des Individuums einer Art auch die vorher jeweils bereits vorhandenen Schritte mit ein.
Beispiele einer solchen Wiederholung sind das Auftreten eines Kiemendarms und von Kiemenspalten bei allen Wirbeltierembryonen. Dies belegt, dass alle heutigen Wirbeltiere von Fischen abstammen. Bartenwalembryonen bilden Zahnanlagen, während die adulten Individuen keine Zähne mehr haben, was darauf hinweist, dass sich die Bartenwale aus Zahnwalen entwickelt haben.
Öffentliche Wahrnehmung
Dass eine Evolution im Sinne eines evolutiven Artenwandels und im Zusammenhang mit regelmäßigen Aussterbeereignissen auftrat, wurde seit jeher von einzelnen Personen oder von einem mehr oder weniger großen Teil der Bevölkerung in Abrede gestellt, wobei es lediglich in der frühen Phase auch um wissenschaftliche Argumente ging. Überwiegend geht es um grundsätzliche Haltungen auf Basis eines völlig anders konzipierten Weltbildes, das häufig auch den Planeten Erde selbst als nur einige tausend Jahre alt betrachtete. Manchmal wurden Einzelaspekte, wie ein ein- oder mehrmaliges Massenaussterben, das dann als mit den religiös inspirierten Sintflutberichten in Einklang gebracht wird, akzeptiert, nicht aber andere Komponenten und Konsequenzen.
Wo das Prinzip der Evolution anerkannt wurde, wurden Teilaspekte davon in den letzten etwa 150 Jahren aber auch losgelöst von ethischen Prinzipien als Mandat und Maxime eines politischen Handelns in der menschlichen Gesellschaft interpretiert und gefordert. Besonders im Fokus stand das Konzept eines universellen und auch die menschlichen Gesellschaften und „Rassen“ umfassenden „Kampfes ums Überleben“, der aus dem Selektionsgedanken abgeleitet wurde und zur Haltung im Sozialdarwinismus führte. Eine besondere Bedeutung erlangte in diesem Zusammenhang auch die Idee der Eugenik, die ab dem letzten Viertel des 19. Jahrhunderts im angelsächsischen Bereich populär wurde und dort beispielsweise die Einwanderungspolitik mit bestimmte. Nach Übernahme der zugrunde liegenden Theorien und Ansichten auch in andere Staaten und in deren politische Führungen kam es vor allem in Deutschland zu den radikalsten und folgenschwersten Auswirkungen zur Zeit des Nationalsozialismus (1933–1945). Aufgrund des damit verbundenen Massenmordes wurde Evolution und die damit zusammenhängende Theorie längere Zeit speziell im deutschen Sprachraum wissenschaftlich überwiegend ausgeblendet und wenig bearbeitet. Wesentliche der modernen Forschungsentwicklungen fanden über Jahrzehnte nur noch im angelsächsischen Bereich statt.
Eine grundsätzliche Gegnerschaft des Prinzips einer Evolution irdischen Lebens, speziell soweit auch die Spezies bzw. Gattung Mensch selber samt ihren Eigenschaften, wie Bewusstsein und geistiger Kreativität, in die Betrachtung einbezogen werden, wurde längere Zeit und wird erneut seit einigen Jahrzehnten verstärkt von wissenschaftsskeptischen Bevölkerungsgruppen vertreten. Sie halten eine allein den Naturgesetzen unterworfene Entwicklung zu einem Wesen wie dem Menschen für entweder grundsätzlich unvereinbar mit ihrem Weltbild oder für so unwahrscheinlich, dass sie eine übergeordnete lenkende Instanz, einen Gott, postulieren, der entweder die Arten erschaffen hat oder mindestens den Ablaufprozess eingeleitet oder gelenkt hat. Diese fundamentale Kontroverse ist in Europa vor allem durch die Auswirkungen um den Streit über die Vermittlung der Evolutionstheorie im schulischen Biologieunterricht mancher US-Bundesstaaten bekannt geworden. Die entsprechenden Vertreter argumentieren häufig mit dem exakten Wortlaut der Schöpfungsgeschichte, wie sie im alten Testament formuliert ist und folgen ihm wortgenau. Diese Skepsis bezüglich der Ergebnisse der Evolutionstheorie wird als Kreationismus bezeichnet. Eine Spezialform des Kreationismus ist die US-amerikanische Intelligent-Design-Idee.
Die katholische Kirche äußerte sich wiederholt zur Evolutionstheorie, so Papst Pius XII. in seiner Enzyklika Humani generis, Papst Johannes Paul II. auf der Vollversammlung der Päpstlichen Akademie der Wissenschaften und Papst Benedikt XVI. in seiner Predigt zur Amtseinführung. Die Evolutionstheorie wird heute vom Vatikan als „vereinbar mit dem christlichen Glauben“ bezeichnet,[38] siehe auch Theistische Evolution. Der Wiener Erzbischof und Kardinal Christoph Schönborn sprach sich mit dem Satz "Evolution kann wahr sein" für eine "große Koalition" von Biologie und Theologie aus. Das Bibelverständnis des Kreationismus sei nicht jenes der katholischen Kirche.[39]
In der frühislamischen wissenschaftlichen Blütezeit sind, teilweise in Anlehnung an griechische Vorbilder, darunter namentlich Aristoteles, Tierbeschreibungen und auch Gedankengänge formuliert worden, die bereits an die evolutionsbiologischen Diskussionen des 19. Jahrhunderts erinnern, darunter „lamarckistische“ Umwelteinflüsse auf die Evolution, aber auch über einen „Kampf ums Dasein“ wurde spekuliert, was an Charles Darwin erinnert. Prominenter Vertreter war Al-Dschahiz im 9. Jahrhundert aus Basra im heutigen Südirak. Im derzeitigen, durch stark divergierende Strömungen gekennzeichneten Islam gibt es keine einheitliche Meinung darüber, ob und in welchem Maße Evolution mit der Religion vereinbar sei; eine evolutionsskeptische Haltung ist relativ weit verbreitet:[40] In etlichen islamisch geprägten Ländern ist eine große Mehrheit der Menschen auch davon überzeugt, dass sich die heutige Spezies Homo sapiens nicht evolutionär entwickelt hat, sondern statisch ist und von Gott (Allah) erschaffen wurde.[41]
Literatur
- Richard Dawkins: The Selfish Gene. Reissued in new covers. Oxford University Press, Oxford 1999, ISBN 0-19-286092-5 (dt.: Das egoistische Gen).
- Douglas J. Futuyma, Mark Kirkpatrick: Evolution. 4. Auflage. Sinauer 2017, ISBN 978-1-60535-605-1.
- Ulrich Kutschera: Evolutionsbiologie. 3. Auflage. Verlag Eugen Ulmer, Stuttgart 2008, ISBN 978-3-8252-8318-6.
- Ernst Mayr: Artbegriff und Evolution. Parey-Verlag, Hamburg 1967.
- Ernst Mayr: Das ist Evolution. Goldmann, München 2005, ISBN 3-442-15349-2.
- Volker Storch, Ulrich Welsch, Michael Wink: Evolutionsbiologie. 3. Auflage. Springer Spektrum Verlag, Heidelberg 2013, ISBN 978-3-642-32835-0.
Weblinks
- Evolutionsbiologie in Deutschland Umfassende Seite mit Literaturempfehlungen, Texten und weiteren Links
- AG Evolutionsbiologie Internetbibliothek mit zahlreichen Texten und ausgewählter Fachliteratur zur Evolution sowie Literaturempfehlungen
- Evolution – Zufall und Zwangsläufigkeit der Schöpfung Audiomitschnitte der öffentlichen Ringvorlesung an der Universität Göttingen im Wintersemester 2007/08
- Henry Gee, Rory Howlett and Philip Campbell – 15 evolutionary gems (PDF; 357 kB) Artikel über 15 Fälle der aktuellen Forschung, die die Darwin’sche Evolutionstheorie belegen. nature, 2009. doi:10.1038/nature07740.
- www.talkorigins.org Englischsprachige Sammlung der häufigsten Missverständnisse bezüglich der Evolutionstheorie und wie Wissenschaftler darauf antworten
- Geheimnisse der Evolution - Leben im Wasser. Dokumentation. ZDFinfo, abgerufen am 18. Januar 2022 (Synchronfassung ZDF 2019. Ein Film von Pierre-François Gaudry. Unter Mitwirkung von Guillaume Lecointre, Sarah Gabbot, Gavin Young, Bradley Smith, Andrew Gillis, John Long und Patrick Tschupp).
- Geheimnisse der Evolution - Leben an Land. Dokumentation. ZDFinfo, abgerufen am 19. Januar 2022 (Synchronfassung ZDF 2019. Ein Film von Pierre-François Gaudry. Unter Mitwirkung von Vera Weisbecker, Mihaela Parlicev, Guillaume Lecointre, Bradley Smith, Heather Smith, Michel Laurin, William Parker, Antoine Balzeau, Sergio Almécija, Henrik Kaessmann und Josh Griffiths).
Einzelnachweise
- ↑ F. D. Ciccarelli, T. Doerks, C. von Mering, C. J. Creevey, B. Snel, P. Bork: Toward automatic reconstruction of a highly resolved tree of life. In: Science. Band 311, Nr. 5765, 2006, S. 1283–1287, PMID 16513982.
- ↑ A. Stoltzfus: Mutationism and the dual causation of evolutionary change. In: Evol. Dev. Band 8, Nr. 3, 2006, S. 304–317.
- ↑ zum Beispiel Ulrich Kutschera und Karl J. Niklas: The modern theory of biological evolution: an expanded synthesis. In: Naturwissenschaften. Band 91, Nr. 6, 2004, S. 255–276, doi:10.1007/s00114-004-0515-y.
- ↑ Helen Pearson: Genetics: what is a gene? In: Nature. Band 441, Nr. 7092, 2006, S. 398–401, doi:10.1038/441398a.
- ↑ Richard Mayeux: Mapping the new frontier: complex genetic disorders. In: The Journal of Clinical Investigation. Band 115, Nr. 6, 2005, S. 1404–1407, doi:10.1172/JCI2542.
- ↑ James A. Draghi, Paul E. Turner: DNA secretion and gene-level selection in bacteria. In: Microbiology. Band 152, Nr. 9, 2006, S. 2683–2688, doi:10.1099/mic.0.29013-0.
- ↑ James Mallet: Hybrid speciation. In: Nature. Band 446, Nr. 7133, 2007, S. 279–283, doi:10.1038/nature05706.
- ↑ R. K. Butlin, T. Tregenza: Levels of genetic polymorphism: marker loci versus quantitative traits. In: Philosophical Transactions of the Royal Society, B, Biological Sciences. Band 353, Nr. 1366, 1998, S. 187–198, doi:10.1098/rstb.1998.0201, PMC 1692210 (freier Volltext).
- ↑ A. Wetterbom, M. Sevov, L. Cavelier, T. Bergström: Comparative genomic analysis of human and chimpanzee indicates a key role for indels in primate evolution. In: Journal of Molecular Evolution. Band 63, Nr. 5, 2006, S. 682–690, doi:10.1007/s00239-006-0045-7.
- ↑ Roy J. Britten: Divergence between samples of chimpanzee and human DNA sequences is 5 %, counting indels. In: PNAS. Band 99, Nr. 21, 2002,S. 13633–13635, doi:10.1073/pnas.172510699.
- ↑ William Amos, John Harwood: Factors affecting levels of genetic diversity in natural populations. In: Philosophical Transactions of the Royal Society of London, B, Biological Sciences. Band 353, Nr. 1366, 1998, S. 177–186, doi:10.1098/rstb.1998.0200, PMC 1692205 (freier Volltext).
- ↑ M. Andersson, L. Simmons: Sexual selection and mate choice. In: Trends in Ecology and Evolution. Band 21, Nr. 6, 2006, S. 296–302.
- ↑ zum Beispiel J. Hunt, R. Brooks, M. Jennions, M. Smith, C. Bentsen, L. Bussière: High-quality male field crickets invest heavily in sexual display but die young. In: Nature. Band 432, Nr. 7020, 2004, S. 1024–1027.
- ↑ J. R. Krebs, N. B. Davies: Einführung in die Verhaltensökologie Blackwell, 1996, S. 343 ff.
- ↑ Richard Dawkins: The Selfish Gene. 1976.
- ↑ J. R. Krebs, N. B. Davies: Einführung in die Verhaltensökologie. Blackwell, 1996, S. 387 ff.
- ↑ R. Lande: Fisherian and Wrightian theories of speciation. In: Genome. Band 31, Nr. 1, 1989, S. 221–227.
- ↑ M. Whitlock: Fixation probability and time in subdivided populations. In: Genetics. Band 164, Nr. 2, 2003, S. 767–779.
- ↑ S. Otto, M. Whitlock: The probability of fixation in populations of changing size. In: Genetics. Band 146, Nr. 2, 1997, S. 723–733.
- ↑ Andreas Werner, Monica J. Piatek, John S. Mattick: Transpositional shuffling and quality control in male germ cells to enhance evolution of complex organisms. In: Annals of the New York Academy of Sciences. 1341, Nr. 1, April 2015, S. 156–163. bibcode:2015NYASA1341..156W. doi:10.1111/nyas.12608. PMID 25557795. PMC 4390386 (freier Volltext).
- ↑ Christoph Adami: What is complexity?. In: BioEssays. 24, Nr. 12, 22. November 2002, S. 1085–1094. doi:10.1002/bies.10192. PMID 12447974.
- ↑ M. Mitchell Waldrop; Heidi Ledford (Hrsg.), N. Dewar (Zeichnungen): Language: Disputed definitions. §Complexity. In: Nature. 455, Nr. 7216, 23. Oktober 2008, S. 1023–1028. doi:10.1038/4551023a. PMID 18948925.
- ↑ a b c d Giuseppe Longo, Maël Montévil: Randomness Increases Order in Biological Evolution. Hrsg.: Michael J. Dinneen, Bakhadyr Khoussainov, André Nies (= Computation, Physics and Beyond. Lecture Notes in Computer Science (LNTCS). Band 7160). Springer Berlin Heidelberg, 2012, ISBN 978-3-642-27653-8, S. 289–308, doi:10.1007/978-3-642-27654-5_22 (englisch, Online). SemanticScholar, Randomness Increases Order in Biological Evolution. Siehe insbes. Fig. 2 Evolution der Komplexität nach Stephen J. Gould. Diese Darstellung erfolgt auf der Grundlage paläontologischer Beobachtungen.
- ↑ Pascal Sirand-Pugnet, Carole Lartigue, Marc Marenda, Daniel Jacob, Aurélien Barré, Valérie Barbe, Chantal Schenowitz, Sophie Mangenot, Arnaud Couloux, Beatrice Segurens, Antoine de Daruvar, Alain Blanchard, Christine Citti: Being Pathogenic, Plastic, and Sexual while Living with a Nearly Minimal Bacterial Genome. In: PLOS Genet.. 3, Nr. 5, 18. Mai 2007, S. e75. doi:10.1371/journal.pgen.0030075. PMID 17511520. PMC 1868952 (freier Volltext).
- ↑ Heather Maughan, Joanna Masel, C. William Birky Jr., Wayne L. Nicholson: The roles of mutation accumulation and selection in loss of sporulation in experimental populations of Bacillus subtilis. In: Genetics. 177, Nr. 2, 1. Oktober 2007, S. 937–948. doi:10.1534/genetics.107.075663. PMID 17720926. PMC 2034656 (freier Volltext).
- ↑ Michael Ruse: Monad to man: the Concept of Progress in Evolutionary Biology. Harvard University Press, 1996, ISBN 978-0-674-03248-4, S. 526–529 (Webarchive).
- ↑ a b Sean B. Carroll: Chance and necessity: the evolution of morphological complexity and diversity. In: Nature. 409, Nr. 6823, 22. Februar 2001, S. 1102–1109. bibcode:2001Natur.409.1102C. doi:10.1038/35059227. PMID 11234024.
- ↑ a b c
Stephen Jay Gould: The Evolution Of Life On Earths. In: Scientific American, Oktober 1994 (via brembs.net). Siehe insbes. Fig. 2: Progress Does Not Rule. Dazu:
- Cosmic Evolution: Emergence. Auf: Palaeos.de (Zugriff am 6. August 2022). Siehe insbes. die Abb.
- Bruno Contestabile: The Biological Evolution of Pain, 2007. Akt. Stand: 2021. Siehe Fig. 4.
- ↑ a b c
Stephen Jay Gould: Full House: The Spread of Excellence from Plato to Darwin. Harmony Books, USA 1996, 244 Seiten, ISBN 978-0517703946. Three Rivers Pr. 1997, S. 171. Dazu:
- Stephen Jay Gould: The Interview. "Staggering our certainties" about humanity's place at the top of the heap. Interviewer: Scott Rosenberg (Abschrift). Auf: salon vom 23. September 1996.
- Patterns of evolution (types of evolution) §4. Progressive evolution. Auf: Overall Science vom 27. Mai 2018.
- Abb.
- ↑ Aharon Oren: Prokaryote diversity and taxonomy: current status and future challenges. In: Philos. Trans. R. Soc. Lond. B Biol. Sci.. 359, Nr. 1444, 29. April 2004, S. 623–638. doi:10.1098/rstb.2003.1458. PMID 15253349. PMC 1693353 (freier Volltext).
- ↑ Robert Mccredie May, R. J. H. Beverton: How Many Species?. In: Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 330, Nr. 1257, 29. November 1990, S. 293–304. doi:10.1098/rstb.1990.0200.
- ↑ Patrick D. Schloss, Jo Handelsman: Status of the microbial census. In: Microbiol Mol Biol Rev. 68, Nr. 4, 1. Dezember 2004, S. 686–91. doi:10.1128/MMBR.68.4.686-691.2004. PMID 15590780. PMC 539005 (freier Volltext).
- ↑ Noel A. Heim, Jonathan Louis Payne, Seth Finnegan, Matthew L. Knope, Michał Kowalewski, S. Kathleen Lyons, Daniel W. McShea, Philip M. Novack-Gottshall, Felisa A. Smith, Steve C. Wang: Hierarchical complexity and the size limits of life. In: Proc. R. Soc. B., Band 284, Nr. 1857; 21. Juni 2017, S. 20171039; doi:10.1098/rspb.2017.1039, PMID 28637850, PMC 5489738 (freier Volltext), ResearchGate. Siehe insbes. Fig. 1: Aggregated distributions of organismal size. (a) The hypothetical unimodal right-skewed distribution of organismal sizes expected under the Gould model (Aggregierte Verteilungen der Organismengröße. (a) Die hypothetische unimodale rechtsschiefe Verteilung der Organismengrößen, die nach dem Gould-Modell erwartet wird).
- ↑ H. Hua, Z. Chen, X. Yuan, L. Zhang, S. Xiao: Skeletogenesis and asexual reproduction in the earliest biomineralizing animal 'Cloudina'. In: Geology. Band 33. Nr. 4, 2005, S. 277–280.
- ↑ „kambrische Explosion“: Review in S. Conway Morris: The fossil record and the early evolution of the metazoa. In: Nature. Band 361, Nr. 6409, 1993, S. 219–225.
- ↑ Review-Artikel zum Dinosaurier-Vögel-Übergang:
M. A. Norell, X. Xu: Feathered dinosaurs. In: Annual Review of Earth and Planetary Sciences. Band 33, 2005, S. 277–299.
F. Zhang, Z. Zhou, G. Dyke: Feathers and ‚feather-like‘ integumentary structures in liaoning birds and dinosaurs. In: Geological Journal. Band 41, Nr. 3–4, 2006, S. 395–404.
Z. Zhou: The origin and early evolution of birds: Discoveries, disputes, and perspectives from fossil evidence. In: Naturwissenschaften. Band 91, Nr. 10, 2004, S. 455–471.
Z. Zhou, F. Zhang: Mesozoic birds of china – A synoptic review. In: Frontiers of Biology in China. Band 2, Nr. 1, 2007, S. 1–14. - ↑ J. A. Long, G. C. Young, T. Holland, T. J. Senden, E. M. G. Fitzgerald: An exceptional devonian fish from australia sheds light on tetrapod origins. In: Nature. Band 444, Nr. 7116, 2006, S. 199–202.
- ↑ Chris Irvine: The Vatican claims Darwin's theory of evolution is compatible with Christianity. In: telegraph.co.uk. 11. Februar 2009, abgerufen am 30. Mai 2015 (englisch).
- ↑ Schönborn für "Große Koalition" von Biologie und Theologie. Die Presse, 5. März 2009, abgerufen am 12. Oktober 2020.
- ↑ SWR 2009: Islam und Darwin – ein Widerspruch ? – abgerufen am 15. Februar 2016 (Memento vom 1. März 2016 im Internet Archive)
- ↑ PewResearchCenter: The World’s Muslims: Religion, Politics and Society. (Memento vom 30. Oktober 2014 im Internet Archive) 4/2013, S. 132.