Narkose
Die Narkose (nach 1862 über Narcosis seit 1709 von altgriechisch νάρκωσις nárkōsis, deutsch ‚Erstarrung, Lähmung, Betäubung‘ oder als Adjektiv – wie „narkotisch“ im Sinne von einschläfernd 1525 bei Paracelsus[1] – von
, einer Bildung zum
) oder Allgemeinanästhesie (auch Allgemeinbetäubung[2] und Allgemeine Anästhesie;[3] vgl. englisch general anaesthesia), umgangssprachlich auch Vollnarkose und seltener Allgemeinnarkose, ist eine Form der Anästhesie, deren Ziel es ist, Bewusstsein und Schmerzempfindung des Patienten vollständig auszuschalten, um diagnostische oder therapeutische Eingriffe (Operationen) durchführen zu können und sowohl für den Patienten als auch für den Arzt optimale Voraussetzungen dafür zu schaffen. Dazu werden ein oder mehrere Narkosemittel (Allgemeinanästhetika) verabreicht, die auf das zentrale Nervensystem wirken, unter Umständen auch Wirkstoffe zur Entspannung der Skelettmuskulatur. Der Patient ist dabei nicht erweckbar, im Unterschied zu Lokal- und Regionalanästhesieverfahren („Teilnarkosen“), bei denen die Schmerzausschaltung über die Blockade von Nervenfasern nur einzelne Regionen des Körpers umfasst.
Die Allgemeinanästhesie wird meist unter geplanten Umständen im Rahmen einer Operation durchgeführt, wird jedoch auch bei interventionellen Eingriffen sowie bei Eingriffen in der Veterinärmedizin eingesetzt. Bei der endotrachealen Intubation beim Atemwegsmanagement in der Notfall- und Intensivmedizin kann ebenfalls eine Narkose eingesetzt werden, zur Fortführung der Beatmungstherapie ist anschließend eine Sedierung ausreichend.
In der Mitte des 19. Jahrhunderts wurden erstmals, beginnend 1846 in Boston, Inhalationsnarkosen als Allgemeinanästhesien im heutigen Sinne durchgeführt, aber erst durch die Entwicklung moderner Narkosegeräte, Methoden der Atemwegssicherung, gut steuerbarer Anästhetika und technischer Überwachungsverfahren sowie durch die Etablierung des Fachgebietes der Anästhesiologie, der Ausbildung spezialisierter Fachärzte und der Entwicklung von Richtlinien und Algorithmen erreichte die Allgemeinanästhesie ihren Status als risikoarmes Routineverfahren, welches schmerzhafte Eingriffe in die Körperintegrität in heutigem Ausmaß und Verbreitung erst ermöglicht. Eine Narkose ist, ebenso wie eine Operation, ein ärztlicher Eingriff in die Körperintegrität (und somit juristisch eine Körperverletzung), der eine entsprechende Vorbereitung und Aufklärung des Patienten und dessen Einwilligung erfordert.
Die eine Narkose durchführende Person wird als Narkosearzt oder Anästhesist, früher (ohne spezielle akademische Ausbildung für das Fachgebiet) als Narkotiseur, bezeichnet; wer sich wissenschaftlich mit der Anästhesie beschäftigt als Anästhesiologe. Die Lehre der Narkose wurde im 20. Jahrhundert als Narkologie[4] bezeichnet.
Übersicht
Komponenten und Definitionen der Allgemeinanästhesie
Eine allgemein anerkannte Definition des Zustandes der Allgemeinanästhesie existiert nicht. Eine solche besteht aus verschiedenen Dimensionen, was sich schon im 19. Jahrhundert in der Namensgebung der Ätheranwendung widerspiegelte. Anästhesie setzt sich aus dem altgriechisch ἀν- „un-, nicht“ und
„Wahrnehmung“ zusammen.
Narkose ist aus altgriechisch νάρκωσις, nárkōsis entlehnt und seit dem 18. Jahrhundert im Deutschen nachweisbar. Verwandte Wörter im Griechischen sind das Verb ναρκάειν, narkáein, „betäuben“, „erstarren“ und das Substantiv νάρκη, nárkē, „Lähmung“, „Schläfrigkeit“.[5]
Die beiden Bezeichnungen betonen verschiedene Aspekte, die eine Betäubung mit Äther bewirkte, auf der einen Seite die Abwesenheit unangenehmer Empfindungen, auf der anderen Seite die Bewegungslosigkeit, die eine Operation ermöglichte.[6] Die Begriffe Allgemeinanästhesie und Narkose werden heute als Beschreibung weitgehend synonym genutzt.[6][7][8]
Heute werden von den meisten Autoren als Dimensionen einer Allgemeinanästhesie Bewusstseinsausschaltung (mentale Komponente), Schmerzausschaltung (Analgesie, sensorische Komponente) sowie Bewegungslosigkeit (motorische Komponente, gegebenenfalls als Muskelrelaxation) unterschieden. Üblicherweise geht dies mit der Dämpfung vegetativer Reaktionen (reflektorische Komponente auf Schmerzreize: Blutdruckanstieg, beschleunigte Herzfrequenz) und einem Gedächtnisverlust (Amnesie) einher. Ob und in welchem Ausmaß jede dieser Komponenten für die Durchführung benötigt wird, wird kontrovers diskutiert, beispielsweise stört eine leichte Bewegung des Patienten in Allgemeinanästhesie nicht notwendigerweise Eingriffe an anderen Körperregionen.
Moderne Definitionsversuche definieren auf dieser Grundlage die Allgemeinanästhesie als eine medikamenteninduzierte Bewusstlosigkeit, während der die Patienten, auch durch Schmerzimpulse, nicht erweckbar sind (“General Anesthesia is a drug-induced loss of consciousness during which patients are not arousable, even by painful stimulation”, American Society of Anesthesiologists).[9] Eine andere Formulierung definiert eine Allgemeinanästhesie als eine durch den Arzt (iatrogen) induzierte, umkehrbare (reversible) Unempfindlichkeit des gesamten Organismus mit dem Ziel, eine Intervention zu ermöglichen.[7]
Abgrenzung
Die Grenze einer Allgemeinanästhesie zu einer (Analgo-)Sedierung ist fließend. Bei dieser werden ebenfalls die Funktionen des zentralen Nervensystems gedämpft, der Patient ist jedoch erweckbar. Sedierung und Anästhesie unterscheiden sich jedoch auch in Hinsicht auf Beeinträchtigung der Atemfunktion und des Kreislaufes (vgl. Tabelle). Je tiefer eine Sedierung ist, desto mehr ist von einer Beeinträchtigung dieser lebensnotwendigen Funktionen auszugehen. Als Konsequenz müssen bei zunehmender Sedierungstiefe weitgehendere Maßnahmen durch Überwachung und gegebenenfalls Stabilisierung durchgeführt werden, etwa die Verabreichung von Sauerstoff mittels Maske (Insufflation). Bei der Allgemeinanästhesie als maximale Ausprägung dieses Spektrums muss die Atemfunktion komplett übernommen werden und unter Umständen kreislaufstabilisierende Maßnahmen mit entsprechenden Mitteln (Infusionen, kreislaufunterstützende Medikamente) eingesetzt werden.
| Körperfunktion | Leichte Sedierung | Tiefe Sedierung | Allgemeinanästhesie |
|---|---|---|---|
| Ansprechbarkeit | erweckbar | erweckbar mit Stimulation oder Schmerzreiz | nicht erweckbar |
| Atemwegssicherung | nicht notwendig | möglicherweise notwendig | in der Regel notwendig |
| Eigene Atmung | ausreichend | möglicherweise reduziert | in der Regel nicht mehr vorhanden |
| Herz-Kreislaufsystem | in der Regel nicht beeinträchtigt | in der Regel nicht beeinträchtigt | möglicherweise beeinträchtigt |
Die Prämedikation vor einer Anästhesie/Operation bewirkt eine leichte Sedierung, das Hauptziel ist jedoch die angstlösende Wirkung (Anxiolyse).
Bei Lokal- und Regionalanästhesieverfahren wird über die Blockade von Nervenfasern eine Schmerzausschaltung in einzelnen Regionen des Körpers ermöglicht; das Bewusstsein ist im Unterschied zur Allgemeinanästhesie nicht betroffen, Atmung und Kreislauffunktion sind unverändert.
Hypnosetechniken werden zum Erreichen einer Trance, gekennzeichnet durch geänderte Aufmerksamkeit und Entspannung, eingesetzt. Die verschiedenen Qualitäten einer Allgemeinanästhesie werden nicht erreicht. Es gibt Hinweise, dass der Einsatz von Hypnose als schmerztherapeutisches Verfahren oder in Kombination mit Anästhesieverfahren (Hypnoanästhesie) positive Effekte auf das Ergebnis von Operationen hat. Es gibt jedoch keine guten Belege für eine Wirksamkeit, die bisher verfügbaren Daten beruhen auf sehr unterschiedlichen Studien mit kleinen Fallzahlen, so dass eine abschließende Bewertung nicht möglich ist.[10][11]
Pharmakologie
Die unterscheidbaren Qualitäten einer modernen Allgemeinanästhesie werden im Gegensatz zu einer Mononarkose durch verschiedene Medikamente hervorgerufen, die als Anästhetika bezeichnet werden. Seit Einführung der Muskelrelaxantien zu Beginn der 1950er Jahr konnte die Intubation erleichtert werden und durch Kombinationsnarkosen unter Verwendung von Analgetika, Hypnotika und Relaxantien die Sicherheit von Allgemeinnarkosen durch weniger Bedarf an den potentiell toxisch auf Herz, Kreislauf und Stoffwechsel wirkenden Einzelkomponenten erhöht werden.[12] Jede Kombination der Substanzgruppen mittels Injektion und über die Atemluft wird als balancierte Anästhesie (in Amerika als balanced anaesthesia entwickelt[13]) bezeichnet.[7]
Bei Anästhetika, die intravenös verabreicht werden, unterscheidet man verschiedene Wirkstoffgruppen:
- Hypnotika: Der Bewusstseinsverlust entsteht durch die Injektion von Schlafmitteln wie Propofol, Thiopental, Methohexital, Etomidate oder Stoffen aus der Gruppe der Benzodiazepine. Der Wirkschwerpunkt dieser Substanzen ist der GABAA-Rezeptor, dem wichtigsten inhibitorischen Rezeptor im zentralen Nervensystem, der seine Wirkung durch die Beeinflussung der Permeabilität für Chlorid-Ionen ausübt. Besondere Funktion hat der Rezeptor im Thalamus bei der Einleitung und Aufrechterhaltung des Schlafs. Die Hypnotika haben keinen wesentlichen schmerzlindernden und nur einen geringen muskelerschlaffenden Effekt.
- Analgetika: Es werden hochwirksame Schmerzmittel, in der Regel Opioide wie Fentanyl, Sufentanil, Remifentanil oder Alfentanil eingesetzt, deren primärer Wirkort die verschiedenen Opioidrezeptoren sind, wobei die analgetische Wirkung hauptsächlich durch die Beeinflussung der Permeabilität für Kalzium-Ionen verursacht wird. Ebenso wie Ketamin (Wirkung am NMDA-Rezeptor), das eine Alternative darstellt, wirken Opioide in höherer Dosierung auch bewusstseinsdämpfend. Analgetika und Hypnotika bewirken auch eine Unterdrückung der Merkfähigkeit (Amnesie) und eine Dämpfung vegetativer Funktionen.
- Muskelrelaxanzien: Eine Muskelerschlaffung entsteht durch Muskelrelaxanzien wie Rocuronium, (cis-)Atracurium, Mivacurium, Vecuronium, Pancuronium oder Succinylcholin. Diese blockieren die neuromuskuläre Reizübertragung an den nikotinischen Acetylcholinrezeptoren der motorischen Endplatte, wodurch eine reversible Lähmung hervorgerufen wird. Eine Wirkung auf das zentrale Nervensystem besteht nicht, weshalb keinerlei schmerzstillender oder bewusstseinsdämpfender Effekt vorhanden ist. Eine Muskelrelaxation erleichtert dem Anästhesisten die endotracheale Intubation im Rahmen der Atemwegssicherung, da die Intubationsbedingungen deutlich verbessert und Schäden am Kehlkopf vermindert werden. Sie muss im Verlauf der Narkose nicht bei allen Arten von Operationen fortgeführt werden, wird aber in der Regel bei Eingriffen im Bauchraum benötigt.
Inhalationsanästhetika wie Sevofluran, Isofluran, Desfluran oder Lachgas werden über die Atemluft zugeführt. Die Flurane bewirken hauptsächlich einen Bewusstseinsverlust, daneben eine leichte Muskelerschlaffung und Schmerzlinderung. Lachgas hingegen wirkt stark analgetisch, hat jedoch nur einen geringen hypnotischen und keinen muskelrelaxierenden Effekt. Die frühesten Substanzen zur Inhalationsanästhesie[14] waren Lachgas, Diethylether („Äther“) und Chloroform.[15]
Die Neuroleptanalgesie als Kombination von Neuroleptika mit Opioiden hat als Alternative zur heutigen Allgemeinanästhesie nur noch historischen Stellenwert.
Theorien zu Wirkmechanismen
Für die verschiedenen Dimensionen der Narkose werden die komplexen Wirkungen auf eine Reihe von Rezeptoren und Ionenkanälen, sowie auf andere Modifikation der synaptischen Signalübertragung verantwortlich gemacht, die für die einzelnen Anästhetika auch noch in unterschiedlichem Ausmaß existieren. Beteiligt sind neben dem oben genannten GABAA- und NMDA-Rezeptor und den Opioidrezeptoren auch Rezeptoren für andere Neurotransmitter, sowie die Natrium- und Kalium-Kanäle in den Zellmembranen der Nervenzellen. Die anatomischen Wirkorte im zentralen Nervensystem sind hauptsächlich die Großhirnrinde, das Rückenmark und der Thalamus. Die Anästhetika, insbesondere die Inhalationsanästhetika, weisen dabei sehr komplexe Wirkungen auf diese Rezeptoren auf, die in ihrer Gesamtheit und Interaktion noch Gegenstand der Forschung sind. Neben den direkten Wirkungen auf die aus Proteinen aufgebauten Rezeptoren und Ionenkanäle wurde in der Vergangenheit für die Inhalationsanästhetika (gemäß der Meyer-Overton-Hypothese) eine unspezifische Wirkung auf die Lipidbestandteile des zentralen Nervensystems angenommen, welcher aber heute weniger Bedeutung zugemessen wird. Sie kann letztlich jedoch nicht ganz ausgeschlossen werden und eine Beteiligung an den Anästhesieeffekten wird weiterhin diskutiert. Eine umfassende Narkosetheorie, die sich aus den bekannten Mechanismen erklären lässt, liegt deshalb noch nicht vor.[16][17]
Indikationen und Gegenanzeigen
Anwendungsgebiete

Das klassische Einsatzgebiet der Allgemeinanästhesie ist die Erzeugung einer Toleranz gegenüber einer Operation. Schmerzhafte Eingriffe in die Körperintegrität wurden in heutigem Ausmaß und Verbreitung erst durch die Entwicklung der modernen Allgemeinanästhesie ermöglicht. An allen Körperregionen werden von verschiedenen Disziplinen der Medizin (chirurgische Fächer und andere operative Fächer, Geburtshilfe, Psychiatrie und interventionelle Radiologie) heute solche Eingriffe zu therapeutischen, teilweise auch zu diagnostischen Zwecken (Probenentnahmen) durchgeführt. Nach dem Beginn der modernen Anästhesie vor 150 Jahren hat sich die Anästhesie als spezialisiertes Fachgebiet herausgebildet.
Im 20. Jahrhundert ergaben sich weitere Indikationen für die Durchführung einer Allgemeinanästhesie in der Notfall- und Intensivmedizin. Insbesondere bei der Sicherung der Atemwege mittels endotrachealer Intubation wird sie eingesetzt, da ansonsten Abwehrreflexe das Einführen des Beatmungsschlauches (Tubus) erschweren. Auch Stressreduktion und Sauerstoffbedarfsreduktion sowie nicht beherrschbare Krampfanfälle in der Notfallmedizin sind Indikationen für eine Narkoseeinleitung.[18] Zum Fortführen der Beatmung ist meist eine Sedierung mit ausreichender Analgesie ausreichend. Die Zielsetzung, Patienten so tief zu sedieren, dass sie während der gesamten Beatmungszeit in einem narkoseähnlichen Zustand sind, wurde in den letzten Jahren zunehmend verlassen. Eine tiefe Sedierung oder gar begleitende neuromuskuläre Blockade ist nur noch wenigen speziellen Indikationen vorbehalten. Ausnahmen sind eine nicht adäquate Ventilation bei Schwierigkeiten, den Patienten an die maschinelle Beatmung zu adaptieren, Hirndrucksymptomatik mit drohender Einklemmung oder Senkung des Sauerstoffverbrauchs bei drohender Hypoxie.
Unterschiede ergeben sich in den verschiedenen Einsatzgebieten vor allem aus der Dringlichkeit der Durchführung: Bei einer geplanten Operation kann die Allgemeinanästhesie unter kontrollierten Bedingungen am aufgeklärten, evaluierten, nüchternen, prämedizierten Patienten durchgeführt werden. In der Notfallmedizin ist die Krankengeschichte des Patienten (Anamnese) oft nicht bekannt, der Patient muss als nicht nüchtern betrachtet werden und die örtlichen, zeitlichen und personellen Gegebenheiten sind oft ungünstig. Dadurch kann die Auswirkung der Narkosemittel auf die Kreislaufstabilität beim verletzten oder akut erkrankten Patienten schwerer einschätzbar sein, als es bei geplanten Eingriffen der Fall wäre.[18]
Gegenanzeigen
Gegenanzeigen (Kontraindikationen) zur Durchführung einer Allgemeinanästhesie sind beispielsweise die Ablehnung durch den Patienten, schwerwiegende Vorerkrankungen, Zustände mit fehlender Nüchternheit oder Schwangerschaft. Die Gegenanzeigen sind als relativ anzusehen, wenn ein lebensbedrohlicher oder nicht verzichtbarer operativer Eingriff oder eine Atemwegssicherung durchgeführt werden müssen. Unter diesen Umständen müssen dann Nebenwirkungen und mögliche Komplikationen beachtet werden und ggf. mit erweiterten Überwachungs- und Therapiemaßnahmen beherrscht werden.
Alternativen zur Allgemeinanästhesie bestehen bei einem Teil der Operationen in örtlich wirksamen Lokalanästhesieverfahren. Bei diesen wird durch die gezielte Applikation von Lokalanästhetika eine zeitweilige, umkehrbare Funktionshemmung von Nerven hervorgerufen, was zu Empfindungslosigkeit und Schmerzfreiheit in bestimmten Körperregionen führt, ohne das Bewusstsein zu beeinträchtigen. Man unterscheidet dabei Oberflächenanästhesie, Infiltrationsanästhesie sowie Leitungsanästhesien (Regionalanästhesieverfahren) peripherer oder rückenmarksnaher Nerven. Mittels örtlicher Anästhesieverfahren lassen sich Probleme der Allgemeinanästhesie bei bestimmten Patientengruppen vermeiden, etwa bei einer Veranlagung zu postoperativer Übelkeit oder maligner Hyperthermie (s. a. u.). Das Einsatzspektrum dieser Methoden ist allerdings begrenzt. So müssen beispielsweise Eingriffe in den Körperhöhlen (Bauch- und Brustraum, Schädel) in der Regel in Allgemeinanästhesie durchgeführt werden.
Überwachung des Patienten
Die Überwachung des Patienten stellt eine Kernaufgabe des Anästhesisten dar. Die unmittelbare Überwachung der Körperfunktionen wird als Monitoring bezeichnet. Dies geschieht durch Untersuchungsmethoden des Arztes, apparatives Monitoring sowie kontinuierlich oder intermittierend durchgeführte Labortests (Point-of-Care-Testing). Ziel der Überwachung ist es, die Sicherheit des Patienten zu gewährleisten, kritische Situationen zu erkennen und die Steuerung der Allgemeinanästhesie zu ermöglichen.[19][20]
Das Ausmaß des Monitorings wird an den Gesundheitszustand des Patienten und das Ausmaß des Eingriffes angepasst. Als unabdingbares Basismonitoring gelten ein genormtes Narkosegerät (nach EN 740) mit der Möglichkeit zur Überwachung von EKG, nichtinvasiver Blutdruckmessung, Überwachung des Blutsauerstoffgehaltes (Pulsoximetrie), Überwachung der CO2-Ausatmung (Kapnometrie) und der Messung der Atemgaskonzentrationen. Zur Verfügung stehen zudem vielfältige weitere Verfahren, die bei Bedarf eingesetzt werden: Temperaturüberwachung, Überwachung der Muskelentspannung (Relaxometrie), Messung des zentralen Venendrucks, invasive Blutdruckmessung, Blutgasanalyse, Pulskonturanalyseverfahren, Transösophageale Echokardiographie, Neuromonitoring etc.[19][21]
Durchführung
Eine Allgemeinanästhesie wird heute in den meisten Fällen durch die Verabreichung von Anästhetika verschiedener Wirkstoffgruppen durchgeführt. Die Medikamente können sowohl über eine Vene (intravenös, als intravenöse Narkose) als auch die Atemluft (per inhalationem, als Inhalationsnarkose) verabreicht werden. Bei einer total intravenösen Anästhesie (TIVA) werden die Medikamente ausschließlich intravenös verabreicht, wobei meist Spritzenpumpen verwendet werden. Gründe dafür sind unter anderem Gegenanzeigen für Narkosegase, fehlende Möglichkeiten zur Gasabsaugung oder Neigung zu starker postoperativer Übelkeit.
Eine gleichzeitige Anwendung von Regionalanästhesieverfahren wird als Kombinationsanästhesie bezeichnet, wodurch sich Narkosemittel einsparen lassen und nach der Operation eine effektive Schmerztherapie durchgeführt werden kann. Dies wird etwa bei Bauch- (Laparotomie) oder Brustkorbeingriffen (Thorakotomie) in Kombination mit einem Periduralkatheter oder bei knochenchirurgischen Eingriffen, meist in Kombination mit einem peripheren Schmerzkatheter, praktiziert.
In den meisten Ländern wird die Anästhesie durch einen Facharzt ausgeführt, dem Anästhesisten. Ihm steht in Deutschland eine Anästhesiepflegekraft zur Seite, die ebenfalls häufig über eine definierte Fachweiterbildung verfügt. Die Durchführung durch einen Assistenzarzt in Weiterbildung muss grundsätzlich unter unmittelbarer Aufsicht eines Facharztes vorgenommen werden, wobei Blick- oder Rufkontakt zwischen beiden bestehen muss („Facharztstandard“). In anderen Ländern, etwa in den USA oder in Schweden, liegt die Durchführung in den Händen nichtärztlicher Anästhesieassistenten (Nurse Anaesthesists, in Schweden Anestesisjuksköterskor, in der Schweiz eidg. dipl. Anästhesiepflegefachperson HF), ein Anästhesist für mehrere Patienten steht für Komplikationen zur Verfügung. Von der Rechtsprechung und den Fachgesellschaften in Deutschland wird die Durchführung einer Allgemeinanästhesie jedoch als ärztliche Aufgabe betrachtet, deren Übertragung in Kernaspekten nicht möglich ist.[22][23]
Vorbereitungen
Vorgespräch und Aufklärung
Anamnese und körperliche Untersuchung bilden die Grundlage des Vorgespräches, wobei sich der Anästhesist ein Bild über den Gesundheitszustand des Patienten verschafft. Bei entsprechenden Vorerkrankungen fordert er unter Umständen weitere Untersuchungen an, um diese einzuschätzen und gegebenenfalls behandeln zu können. Dabei kann es sich um Laboruntersuchungen oder eine 12-Kanal-EKG-Ableitung, Ergometrie, Echokardiografie oder Lungenfunktionsprüfung handeln. Die Dauermedikation des Patienten wird möglicherweise vor dem Eingriff verändert, insbesondere bei gerinnungshemmenden Medikamenten.[24]
Der Patient muss der Durchführung einer Allgemeinanästhesie als ärztlichem Eingriff in die Körperintegrität zustimmen, sofern er dazu in der Lage ist. Bei nicht entscheidungsfähigen Erwachsenen muss ein legitimierter Vertreter dies übernehmen, der ein gerichtlich bestellter Betreuer oder ein vom Patienten per Vorsorgevollmacht bestimmter Bevollmächtigter sein kann. Bei Kindern stimmen die Sorgeberechtigten zu. In Deutschland gelten Kinder bis 14 Jahre als nicht einwilligungsfähig, von 14 bis 18 Jahren können sie selbst zustimmen, wenn der aufklärende Arzt den Eindruck einer ausreichenden psychosozialen Reife hat. Damit der Patient die Tragweite seiner Einwilligung überblicken und rechtswirksam einwilligen kann (informierte Einwilligung), muss eine ärztliche Aufklärung durch den Anästhesisten über Risiken und Alternativen zur Allgemeinanästhesie erfolgen. Diese muss rechtzeitig, in der Regel mindestens am Vortag, erfolgen. Bei ambulant durchgeführten Eingriffen ist eine Aufklärung und Einwilligung am Operationstag erlaubt. Bei Notfalleingriffen oder im Notarztdienst kann der Arzt eine Allgemeinanästhesie gemäß dem mutmaßlichen Patientenwillen auch dann einleiten, wenn eine vorherige Aufklärung nicht möglich war.[25]
Nüchternheit
Vor einem geplanten Eingriff muss eine Nahrungskarenz eingehalten werden, um das Zurückfließen oder Erbrechen von Mageninhalt und dessen Eindringen in die Lunge (Aspiration) bei der Narkoseeinleitung zu vermeiden, da die Anästhetika den Verschluss der Speiseröhre (Verschlusskraft des oberen Ösophagussphinkters) und die Schutzreflexe des Patienten (Husten, Schlucken, Würgen) beeinträchtigen.[26] Die Fachgesellschaften empfehlen für feste Speisen eine Nüchternheit von sechs Stunden, für klare Flüssigkeiten wie Wasser oder Kaffee mit weniger als einem Fünftel Milch sind zwei Stunden ausreichend, um eine Entleerung des Magens zu gewährleisten. Kinder sollten zuletzt vier Stunden vor dem Eingriff gestillt werden.[27][28] Durch das Verabreichen einer klaren, kohlenhydrathaltigen Trinklösung, das noch keine Routine ist, lassen sich möglicherweise Durstgefühl, Angst und postoperative Übelkeit reduzieren.[29]
Verschiedene Vorerkrankungen können zu einer Verzögerung der Magenpassage führen, bei anderen Patientengruppen ist die Nüchternheit prinzipiell nicht gegeben. In diesen Fällen wird eine modifizierte, schnelle Narkoseeinleitung (Rapid Sequence Induction, s. u.) mit dem Ziel durchgeführt, das Aspirationsrisiko zu mindern.[29]
Rauchverbot
Die Aufnahme von Nikotin hat verschiedene negative Einflüsse auf den Körper und erhöht damit auch das Risiko, dass während einer OP Komplikationen im Bereich des Herzkreislauf- und Lungensystems auftreten können. Wundinfektionen können vermehrt auftreten. Ein erhöhtes Risiko für Magenprobleme oder einer Aspiration im Rahmen der Narkose scheint nach aktuellen Erkenntnissen nicht vorhanden zu sein, da der Magenschließmuskel sich bereits fünf bis acht Minuten nach dem letzten Rauchen normalisiert. Eine geplante OP muss deshalb wegen kürzlichem Nikotinkonsum nicht verschoben werden. Das Rauchen sollte jedoch so früh wie möglich vor einer OP eingestellt werden. Bereits wenige Stunden verbessern hierbei den Sauerstoffgehalt des Blutes durch Absinken des Kohlenstoffmonoxids im Blut. Die Vermutung, durch eine kurz vor der OP erzwungene Nikotinkarenz Stress zu erzeugen, der selbst zu Komplikationen führt, scheint nach neuesten Erkenntnissen unbegründet zu sein.[30]
Narkosevorbereitung und Narkoseeinleitung
Am Morgen der Operation wird bei geplanten Eingriffen bei Bedarf eine Prämedikation verabreicht, deren Hauptziel eine angstlösende Wirkung (Anxiolyse) ist. Heute kommen überwiegend Benzodiazepine als Tablette oder Saft (per os) zur Anwendung. Ergänzend werden bei speziellen Risiken weitere Mittel angeordnet, etwa zur Verminderung der Magensäureproduktion oder zur Prophylaxe allergischer Reaktionen. Bei Kindern ist auch eine rektale (Verabreichung durch den Anus) oder eine nasale Gabe (Zerstäubung mit speziellen Spritzen) der Wirkstoffe möglich (Butzengeiger und Eichholz verwendeten 1926 Avertin zur rektalen Narkose[31]). Die früher praktizierte intramuskuläre Prämedikation (Injektion in einen Skelettmuskel) ist hingegen nicht mehr üblich. Zusätzlich wird bei Kindern oft eine Lokalanästhesie der Haut durch ein Pflaster oder eine Creme (Lidocain/Prilocain-Mischung, Produktname EMLA) im Bereich der geplanten Venenpunktion (Handrücken, Ellenbeuge) durchgeführt.
Die Identität des Patienten, der Eingriff und andere Punkte der WHO Surgical Safety Checklist werden vor der Narkoseeinleitung überprüft.
Die intravenöse Einleitung (Induktion) einer Allgemeinanästhesie erfolgt nach Anlage der Überwachungsmaßnahmen und der Platzierung eines Zugangsweges zur Infusion. Dies ist in der Regel ein peripherer Venenkatheter, bei entsprechender Indikation ein zentraler Venenkatheter. Auswahl und Dosierung der Medikamente erfolgen unter Berücksichtigung von Alter, Gewicht und Vorerkrankungen des Patienten sowie anhand der geplanten Operation.
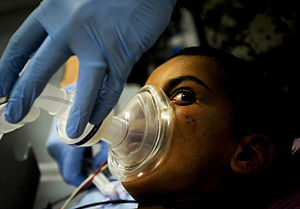
Durch das Vorhalten einer Beatmungsmaske vor Mund und Nase wird dem Patienten in hoher Konzentration Sauerstoff zugeführt um die Lunge mit Sauerstoff anzureichern. (Präoxygenierung). Nach intravenöser Verabreichung des Hypnotikums schläft der Patient ein. Das Aussetzen der Spontanatmung macht dann eine „künstliche“ Beatmung erforderlich. Ist eine endotracheale Intubation beabsichtigt, erfolgt in der Regel die Gabe eines Muskelrelaxans.
Alternativ kann die Narkoseeinleitung inhalativ, durch das Einatmen eines Inhalationsanästhetikums über eine Maske, geschehen. Dies wird vor allem bei Kindern angewendet, die die Punktion einer Vene in wachem Zustand trotz vorheriger Prämedikation nicht tolerieren. Dieses Vorgehen birgt das Risiko, dass bei einer potenziellen Komplikation keine Möglichkeit zur sofortigen intravenösen Applikation eines Medikamentes zur Verfügung steht. Nach der Anflutung des Narkosedampfes wird dann ein venöser Zugang gelegt und die Allgemeinanästhesie mit injizierten Anästhetika im Sinne einer balancierten Anästhesie vervollständigt.
Die Rapid Sequence Induction (RSI) ist eine Sonderform der Narkoseeinleitung. Sie kommt zur Anwendung, wenn für den Patienten ein erhöhtes Risiko besteht, eine pulmonale Aspiration, worunter man das Eindringen von Mageninhalt oder Blut in die Atemwege versteht, zu erleiden. Eingesetzt wird die RSI bei nicht nüchternen Patienten, fortgeschrittener Schwangerschaft, Erkrankungen oder Verletzungen des Magen-Darm-Traktes und Notfallpatienten mit Verletzungen. Zweck der RSI ist es, die Zeitspanne vom Bewusstseinsverlust (mit dem Aussetzen von Schutzreflexen wie Schlucken und Husten) bis zur Sicherung des Atemweges vor aufsteigendem Mageninhalt mittels endotrachealer Intubation so kurz wie möglich zu halten (rapid sequence induction: „schneller Ablauf der Narkoseeinleitung“). Dazu werden verschiedene Vorgänge der Narkoseeinleitung modifiziert: Der Oberkörper kann anders gelagert, eine laufende Absaugmöglichkeit kann bereitgehalten oder schnellwirksame Muskelrelaxanzien wie Succinylcholin oder Rocuronium können eingesetzt werden. Früher wurde ein Druck auf den Kehlkopf (Krikoiddruck nach Sellick) ausgeübt. Der Nutzen einer RSI, insbesondere des Krikoiddrucks, wird jedoch kontrovers diskutiert.[32] Nach den Maßstäben der evidenzbasierten Medizin ist eine Reduktion der Aspirationsrate bzw. der Sterblichkeit daran nicht nachgewiesen.[33]
Atemwegssicherung und Beatmung
Durch die Verabreichung des Hypnotikums und des Analgetikums wird der Atemantrieb des Patienten eingeschränkt oder aufgehoben. Um die Versorgung des Körpers, insbesondere des Gehirns, mit Sauerstoff zu gewährleisten, muss eine künstliche Beatmung des Patienten erfolgen. Diese erfolgt zunächst dadurch, dass dem Patienten mit einer Beatmungsmaske und Druck auf einen Beatmungsbeutel ein Sauerstoff-Luft-Gemisch in die Lunge gedrückt wird, das bei Aufheben des Druckes die Lunge wieder verlässt. Bei kurzen, unkomplizierten Eingriffen kann der gesamte Eingriff in Maskennarkose erfolgen.
- Bei größeren Eingriffen wird als das klassische Verfahren der Atemwegssicherung (Goldstandard) eine endotracheale Intubation durchgeführt. Dazu erfolgt im Regelfall die intravenöse Gabe eines Muskelrelaxans um die Intubationsbedingungen zu verbessern. Nach Einschlafen des Patienten und vor Applikation des Muskelrelaxans galt bis Ende der 2000er Jahre eine Probebeatmung mit einer Atemmaske als obligat um bei Maskenbeatmungsschwierigkeiten von einer Relaxierung absehen zu können. Dadurch bleibt die Option bestehen den Patienten aufwachen und spontan atmen zu lassen.[34] Die Notwendigkeit einer Probebeatmung wurde ab den 2010er Jahren in Frage gestellt,[35][36] unter anderem aufgrund der Möglichkeit eine Rocuronium-basierte Muskelrelaxierung durch Sugammadex rasch antagonisieren zu können.
Bei der Intubation wird ein Beatmungsschlauch (Tubus) durch Mundraum und Kehlkopf (alternativ über die Nase oder über ein Tracheostoma) bis in die Luftröhre eingebracht (Intubationsnarkose, ITN, seltener auch Intubationsanästhesie genannt).[37][38] Die Intubation geschieht meist in direkter Sicht auf die Stimmlippen (direkte Laryngoskopie), wozu der Kehldeckel mittels eines Laryngoskops angehoben wird. Da der Tubus durch eine aufblasbare Blockmanschette (Cuff) in der Luftröhre abgedichtet wird, ist durch dieses Verfahren ein Schutz vor Aspiration von Mageninhalt weitgehend gegeben. Die Intubation wird bei Eingriffen in den Körperhöhlen oder entsprechenden Risiken des Patienten eingesetzt, insbesondere ist sie bei einer Rapid Sequence Induction (RSI) zwingend notwendig. In Fällen, in denen eine schwierige Intubation zu erwarten ist, kann der Tubus auch unter fiberoptischer Kontrolle endoskopisch eingeführt werden. Für Eingriffe im Brustkorb existieren Doppellumentuben, mit denen eine getrennte Beatmung der Lungenflügel möglich ist.
- Bei oberflächlichen Eingriffen und Patienten ohne Risikofaktoren wird seit den 1980er Jahren alternativ die Kehlkopfmaske (Larynxmaske, LMA) eingesetzt. Diese wird in den Rachen des Patienten eingelegt, so dass ihre Öffnung vor dem Kehlkopfeingang zu liegen kommt. Die Abdichtung erfolgt durch einen Kunststoffwulst. Komplikationen der Intubation wie Verletzungen von Zähnen oder Weichteilgewebe werden bei Verwendung der Larynxmaske weitgehend vermieden, jedoch ist der Schutz vor einer Aspiration geringer. Es existieren verschiedene Varianten der Larynxmaske, etwa mit der Möglichkeit, eine zusätzliche Magensonde einzuführen oder durch die Maske einen Endotrachealtubus einzuführen. Alternativen stellen der Larynxtubus und der Combitubus dar, die im Prinzip auf die gleiche Weise funktionieren.[37]
Anästhesieaufrechterhaltung
Die Aufrechterhaltung der Allgemeinanästhesie geschieht oft als balancierte Anästhesie. Dazu werden einem Allgemeinanästhetikum (z. B. durch kontinuierliche Beimischung von Inhalationsanästhetika zur Atemluft) in Kombination dazu Einzeldosen oder kontinuierliche Gaben von Analgetika und Muskelrelaxanzien über den venösen Zugang verabreicht. Bei der total intravenösen Anästhesie geschieht die Unterhaltung hingegen ausschließlich durch eine kontinuierliche Anästhetikaverabreichung meist mittels Spritzenpumpen. Eine reine Inhalationsanästhesie (mit dem Zusatz von Lachgas) ist möglich, aber wenig gebräuchlich.
Der Anästhesist reagiert in der Narkoseführung auf Operationsänderungen, bei einem starken Schmerzreiz muss die Analgesie vertieft werden. Die Beurteilung der Narkosetiefe und Steuerung der Medikamentengabe erfolgt durch klinische Parameter (Blutdruck, Herzfrequenz, Tränenfluss, Schwitzen, Pupillengröße, Pupillenreflex, Bewegungsreaktionen) und eventuell mittels Monitoring-Systemen, die die elektrische Gehirnaktivität (Elektroenzephalografie, akustisch evozierte Potenziale) messen und darstellen, oder durch Messung der Konzentration der Inhalationsanästhetika in der Ausatemluft.[39]
Der Anästhesist ist für die Aufrechterhaltung der elementaren Körperfunktionen (Atmung, Kreislauf, Stoffwechsel, Flüssigkeits-, Elektrolyt- und Säure-Basen-Haushalt, Gerinnungssystem) des Patienten für die Dauer des gesamten Eingriffes zuständig. Gleichzeitig führt er Diagnostik und Behandlung von Komplikationen durch, die aus Operation, Anästhesieverfahren und Vorerkrankungen des Patienten resultieren können. Mittels Infusionstherapie werden Blutverluste und Flüssigkeitsdefizite des Patienten ausgeglichen und unter Umständen auch Blutkomponenten transfundiert. Weiterhin stehen alle wichtigen Medikamente zur Therapie verschiedener Komplikationen (unter anderem Kreislaufstörungen, Verengung der Bronchien, Allergien) zur Verfügung.
Narkoseausleitung
Nach dem Abschluss des Eingriffes wird die Allgemeinanästhesie ausgeleitet. Zur Narkoseausleitung beendet der Anästhesist die Zufuhr der Anästhetika, der Patient erwacht, nachdem die Wirkstoffe abgebaut sind bzw. abgeatmet wurden. Voraussetzung ist, dass Muskelrelaxanzien weitgehend abgebaut sind (ausreichende neuromuskuläre Funktion). Bei Bedarf kann ihre Wirkung aufgehoben (antagonisiert) werden. Ebenso sollte eine ausreichende Analgesie gewährleistet sein. Der Patient sollte normotherm sein, und bei der Checkliste sollte vor dem Verlassen des Operationssaales die Hauptpunkte beim sign out durchgegangen sein. Nach dem Einsetzen einer ausreichenden Spontanatmung des Patienten und vorhandenen Abwehrreflexen (Schlucken, Husten) wird der Tubus oder die Kehlkopfmaske entfernt (Extubation). Sowohl ein agitiertes Erwachen (emergence delirium) als auch verzögertes Aufwachverhalten ist möglich.
Postoperative Überwachung
Die postoperative Überwachung im Anschluss an Operation und Narkose wird bei Routineeingriffen im Aufwachraum durchgeführt, bevor der Patient auf die Normalstation oder bei ambulanten Eingriffen nach Hause entlassen wird. Bei schwer erkrankten oder verletzten Patienten erfolgt unter Umständen die Aufnahme auf eine Intensivstation, gegebenenfalls unter Weiterführung von Beatmung und Sedierung. Der Aufwachraum wird meist durch eine oder mehrere Anästhesie-Pflegekräfte betreut und muss mit entsprechenden Überwachungsgeräten ausgestattet sein. Ein Anästhesist ist ebenfalls anwesend oder in ständiger Rufbereitschaft, um bei Komplikationen eingreifen zu können.
Der Patient bleibt im Aufwachraum, bis er wieder vollständig erwacht ist, im Vollbesitz seiner Schutzreflexe ist und keine Komplikationen von Seiten der Atmung und des Kreislaufes zu erwarten sind. Es wird eine Überwachung der Vitalparameter (Blutdruck, Puls, Atmung) sowie von Ausscheidungen (Urin, Stuhl) und Drainagesystemen durchgeführt. Ein zentrales therapeutisches Ziel in der postoperativen Phase ist die Schmerztherapie mittels Schmerzmitteln oder der Weiterführung von Regionalanästhesieverfahren. Die durch Schmerzbekämpfung und Folgen der Allgemeinanästhesie mögliche Übelkeit wird hier ebenso wie andere postoperative Probleme behandelt.[40][41][42]
Probleme und Risiken
“There should be no deaths due to anaesthesia.”
„Es sollte keine Todesfälle auf Grund der Anästhesie geben.“
Bei der Beurteilung von Komplikationen im Verlauf einer Operation müssen Auswirkungen des operativen Eingriffes, Probleme der Anästhesiedurchführung und Vorerkrankungen des Patienten mit einbezogen werden. Eine klare Abgrenzung zwischen diesen Faktoren ist nicht immer möglich. Die Sterblichkeitsrate aus der Summe dieser Faktoren wird als perioperative Mortalität zusammengefasst, wobei der erfasste Zeitraum perioperativ („Im Rahmen einer Operation“) nicht einheitlich definiert ist. Zahlen zur Häufigkeit von Komplikationen und der Sterblichkeit im Rahmen einer Operation variieren stark. Ursachen sind fehlende einheitliche Definitionen, unterschiedliche Studienpopulationen und unterschiedliche Beobachtungszeiträume.[45][46]
Die Sterblichkeit im Rahmen einer Operation (perioperative Mortalität) korreliert mit dem Gesundheitszustand des Patienten, der durch den ASA-Status ausgedrückt wird. Für einen weitgehend gesunden Patienten (ASA 1–2) beträgt diese statistisch 0,05–0,5 %, während sie für Patienten mit schweren Vorerkrankungen deutlich höher liegt (4,40 % bei ASA-3-Patienten, bis zu 25 % bei ASA 4).[47] Auch mit zunehmendem Lebensalter steigt das Risiko von Komplikationen.[47] Die primär durch die Anästhesieverfahren bedingte Sterblichkeit (Mortalität) bzw. bleibende Schäden (Morbidität) machen jedoch nur einen kleinen Teil dieser Fälle aus. Sie liegt in großen, retro- oder prospektiven Untersuchungen[47][48][49] heutzutage bei 0,001 bis 0,014 % (1–14/100.000 Anästhesieverfahren), im Vergleich zu noch etwa 0,037 % im Jahr 1954.[45] Bei einem Patienten ohne wesentliche Vorerkrankungen wird die Sterblichkeit mit 0,4/100.000 Anästhesiedurchführungen beziffert.[44] Eine rechnerische leichte Zunahme der Komplikationsraten in den letzten Jahren ist durch den überproportionalen Anstieg von operativen Eingriffen bei sehr alten oder multimorbiden Patienten bedingt.[44]
Die Abnahme des Risikos über die letzten Jahrzehnte wird verbesserten Überwachungsmöglichkeiten, hauptsächlich der routinemäßigen Anwendung von Pulsoxymetrie und Kapnometrie, sowie der Entwicklung und Etablierung systematischer Fehlerreduktionsmaßnahmen (Facharztstandard, Richt- und Leitlinien, Algorithmen, Simulatortraining, der Deklaration von Helsinki zur Patientensicherheit in der Anästhesiologie mit der Nutzung von Checklisten, gelebte Fehlerkultur) zugeschrieben. Weltweit sind große Variationen bei den Risikoraten vorhanden, in Entwicklungsländern liegen sie um ein Vielfaches höher.[45][46]
Probleme bei der Atemwegssicherung, ungenügende Betreuung während der Narkose, inadäquates Vorgehen bei Herz-Kreislauf-Komplikationen, Verwechslung von Medikamenten und Fehler in der präoperativen Beurteilung und Patientenvorbereitung sind Hauptursachen der anästhesiebedingten Sterblichkeit. Die Mehrzahl davon wäre potenziell vermeidbar.[45][46]
Störungen der Atmung, Probleme bei der Atemwegssicherung
Schwierigkeiten oder Unmöglichkeit der Atemwegssicherung („schwierige Atemwegssicherung“) sind ein wichtiger Grund für die anästhesiebezogene Sterblichkeit im Rahmen eines operativen Eingriffes. Für solche Fälle wurden Algorithmen entwickelt, durch deren Einsatz eine Kontrolle der Situation erreicht wird. Es wird zwischen erwarteten Schwierigkeiten, die im Vorgespräch erkannt wurden, und der unerwartet schwierigen Atemwegssicherung unterschieden.
Bei erwarteten Problemen besteht die Möglichkeit, einen Tubus mit einem flexiblen Gerät endoskopisch gesteuert und unter Sicht einzuführen (fiberoptische Wachintubation). Dies geschieht bei erhaltener Spontanatmung (in örtlicher Betäubung des Rachens und leichter Sedierung des Patienten), um die Sauerstoffversorgung zu gewährleisten. Bei unerwarteten Problemen mit der Beatmung oder Intubation stehen eine Reihe von Hilfsmitteln (andere Laryngoskopspatel, Videolaryngoskop, Larynxmaske, Larynxtubus, Combitubus etc.) zur Bewältigung der Situation zur Verfügung. Gelingt die Sauerstoffversorgung des Patienten nicht, ist als Mittel der letzten Wahl die chirurgische Eröffnung der Atemwege (Koniotomie) erforderlich.[37][38]
Unter einer Aspiration versteht man das Eindringen von Fremdkörpern in die unteren Atemwege. Im Rahmen der Narkosedurchführung handelt es sich dabei meist um erbrochene oder regurgitierte Nahrungsbestandteile und Sekrete aus dem Magen. Es kann dadurch zu einer Verlegung der Luftwege, in der Folge auch zu einer Lungenentzündung und einem akuten Lungenversagen kommen. Man versucht das Risiko einer Aspiration bei gefährdeten Patienten durch eine Modifikation der Narkoseeinleitung zu verringern (s. o.). Bei erfolgter Aspiration werden, soweit möglich, die Fremdmaterialien endoskopisch aus Luftröhre und Bronchien abgesaugt und der Patient mit reinem Sauerstoff beatmet. In der Folge ist unter Umständen eine Antibiotikatherapie notwendig. Aspirationen verlaufen in der überwiegenden Anzahl gutartig, tödliche Ausgänge sind selten.[29]
Unter einem Bronchospasmus versteht man eine akute Verengung der Bronchien, die durch eine Spastik der glatten Muskulatur verursacht wird. Bronchospasmus-gefährdet sind vor allem Patienten mit Vorerkrankungen der Lunge (Asthma bronchiale, COPD, Infektionen der Atemwege, Nikotinabusus) und Neigung zu allergischen Reaktionen. Auslöser können die Manipulationen bei der Atemwegssicherung oder eine (zu) flache Narkose sein. Es sind erhöhte Beatmungsdrücke notwendig, die Ausatmung des Patienten ist verlängert, häufig kann auch Giemen und Brummen über der Lunge auskultiert werden. Die Behandlung erfolgt durch eine Narkosevertiefung. Unter Umständen ist eine weiterführende Therapie mit bronchienerweiternden Mitteln (etwa β2-Sympathomimetika) erforderlich. Bei Verdacht auf eine allergische Reaktion muss diese entsprechend behandelt werden.[50]
Ein Laryngospasmus ist ein Krampfzustand der Kehlkopfmuskulatur, so dass die Stimmritze (Glottis) verschlossen und eine Atmung nicht mehr möglich ist. Eine solche Situation tritt meist während der Narkoseausleitung auf, wenn der Tubus entfernt wird und sich Sekrete oder Blutreste vor dem Kehlkopfeingang befinden, etwa nach Eingriffen in der Hals-Nasen-Ohren-Heilkunde, wie der Tonsillektomie. Auch während einer zu flachen Narkose mit einer Larynxmaske oder der Narkoseausleitung bei Kindern kann ein Laryngospasmus entstehen. Schnell kann sich ein Sauerstoffmangel (Hypoxie) mit einer Zyanose ausbilden. Die Atemanstrengungen des Patienten sind krampfhaft und frustran, eine Schaukelatmung tritt auf. Teilweise lässt sich mit einer Maskenbeatmung der Widerstand der Stimmlippen noch überwinden und Sauerstoff zuführen. Sekrete müssen aus dem Rachenbereich abgesaugt werden. Löst sich der Laryngospasmus nicht wieder, muss unter Umständen ein schnellwirksames Muskelrelaxans (Succinylcholin) injiziert werden, das die Muskeln des Kehlkopfes erschlaffen lässt.[51]
Herz-Kreislaufstörungen
Die Anästhetika hemmen in verschiedenem Ausmaß die vegetative Regulation der Blutgefäße, insbesondere der Arteriolen, wodurch eine Weitstellung der Gefäße (Vasodilatation) und ein Abfall des Blutdruckes (Hypotonie) resultiert. Auch die Schlagkraft des Herzens wird reduziert (negative Inotropie). Während dies bei gesunden Patienten nur geringe Auswirkungen hat, kommt es bei Vorerkrankungen des Herz-Kreislauf-Systems oder bei Flüssigkeitsmangel oft zu signifikanten Auswirkungen auf den Blutdruck. Der Anästhesist überwacht deshalb den Blutdruck engmaschig, entweder mit nichtinvasiver Blutdruckmessung in kurzen Intervallen oder mittels einer in eine Arterie eingebrachte Drucksonde (invasive Blutdruckmessung), die bei Risikopatienten eine kontinuierliche Überwachung in Echtzeit ermöglicht. Die Therapie des Blutdruckabfalls erfolgt durch einen Ausgleich des Flüssigkeitshaushaltes mittels Infusion sowie durch gefäßverengende Substanzen (Katecholamine) wie Noradrenalin, Cafedrin-Theodrenalin (Akrinor) oder Ephedrin.
Herzrhythmusstörungen während einer Narkose sind häufig, führen aber nur bei einem sehr geringen Teil der Patienten zu schwerwiegenden Komplikationen und müssen dann gezielt mit Antiarrhythmika oder Elektrotherapie behandelt werden. Häufig treten vereinzelte Extrasystolen auf, auch beim herzgesunden Patienten.
Gefürchtet ist ein intraoperativer Herzinfarkt, der bei vorbestehender koronaren Herzkrankheit durch die Belastung des Körpers durch Operationsstress, Blutverlust und Minderdurchblutung des Herzmuskels infolge Tachykardie oder Blutdruckabfall auftreten kann. Schlimmstenfalls kann er zum Herzstillstand führen, der eine Reanimation erfordert. Zur Vermeidung dient eine ausreichende Narkosetiefe, die das vegetative Nervensystem ausreichend dämpft und gleichzeitig das Aufrechterhalten eines ausreichenden arteriellen Blutdruckes. Eine vorbestehende Therapie des herzkranken Patienten mit Betablockern oder Acetylsalicylsäure (ASS) wird heute in der Regel fortgesetzt, obwohl bei letzterem ein leicht höheres Blutungsrisiko vorliegt. Ausnahmen stellen im Einzelfall Eingriffe mit dem Risiko von nicht kontrollierbaren Blutungen dar, etwa Eingriffe innerhalb des Schädels, des Auges oder der Prostata.[52]
Im schlimmsten Fall kommt es durch verschiedene Ursachen zu einem Herz-Kreislaufstillstand, der unverzüglich Wiederbelebungsmaßnahmen notwendig macht. Bei jeder Narkosedurchführung müssen deshalb alle personellen und materiellen Ressourcen zur adäquaten Durchführung eines Advanced Life Supportes zur Verfügung stehen.
Intraoperative Wachzustände
Als intraoperative Wachheit (Awareness) werden Wahrnehmungen des Patienten während einer Allgemeinanästhesie bezeichnet, an die auch im Nachhinein eine Erinnerung besteht. Meist handelt es sich dabei um einzelne Wörter oder Sätze, die in Anwesenheit des Patienten geäußert wurden. In einigen Fällen werden jedoch auch Schmerz, Angst, Panik, Hilflosigkeit wahrgenommen. Obwohl der Großteil der Patienten Awareness-Ereignisse im Nachhinein nicht als belastend empfinden, kommt es in Einzelfällen auch zu behandlungsbedürftigen Erkrankungen bis hin zu einer posttraumatischen Belastungsstörung.[53][54]
Die Häufigkeit von Awareness wird mit 0,1–0,2 % angegeben. Anästhesiebedingte Faktoren, die das Risiko eines Wachzustandes erhöhen, sind der Einsatz von Muskelrelaxanzien, eine schwierige Intubation mit einer verlängerten Phase der Atemwegssicherung sowie eine flache Narkose aufgrund von kardialen Vorerkrankungen, Patienten mit Flüssigkeitsmangel (Verletzungen, Blutverlust bei der Operation) oder technische Defekte, etwa eine Pumpenfehlfunktion bei einer intravenösen Narkosedurchführung. Operationen mit erhöhtem Risiko für intraoperative Wachzustände finden sich in der Traumatologie, Herzchirurgie und in der Geburtshilfe. Patientenbezogene Risikofaktoren sind ein Missbrauch von Alkohol, Benzodiazepinen oder anderen Psychopharmaka sowie Erlebnisse vorangegangener Awareness, weibliches Geschlecht und Übergewicht.[53][54]
Zum Ausschluss von Wachzuständen werden neben der Beobachtung des Patienten technische Überwachungssysteme eingesetzt. Diese Geräte analysieren dabei das Ausmaß der Unterdrückung der elektrischen Hirnaktivität (mittels Elektroenzephalografie) oder der akustischen Wahrnehmungsfähigkeit (Akustisch evozierte Potenziale) des Patienten. Diese Rohdaten werden von einem Computer analysiert und in Maßzahlen umgewandelt. Die Effektivität und der Nutzen (Reduktion der bewussten Erinnerungen, insbesondere solcher mit behandlungsbedürftigen Folgen) werden jedoch kontrovers diskutiert.[53][54] Der Einsatz solcher Geräte gehört deshalb nicht an allen Kliniken zur Routineüberwachung und wird von den Fachgesellschaften nicht uneingeschränkt empfohlen.[55]
Allergische Reaktionen
Allergische Reaktionen während einer Allgemeinanästhesie sind seltene Ereignisse, die Häufigkeit des Auftretens wird mit 1:3.500 bis 1:20.000 angegeben. Sie sind zumeist durch Medikamente bedingt, in etwa 70 % der Fälle durch Muskelrelaxanzien (Succinylcholin, Rocuronium, Atracurium), in 10 % durch andere Anästhetika (Propofol, Thiopental, Opioide, Lokalanästhetika) und in 8 % durch Antibiotika, meist β-Lactame. In etwa 12 % ist Latex in Handschuhen oder Kathetern das Allergen. Pathophysiologisch handelt es sich um Reaktionen vom Typ 1 nach Coombs und Gell, bei denen nach Allergenexposition und IgE-vermittelter Bindung an Mastzellen Botenstoffe wie Histamin, Leukotriene und Prostaglandine ausgeschüttet werden, daneben spielen auch nicht IgE-vermittelte Reaktionen eine Rolle (anaphylaktoide Reaktion).
Das klinische Bild ist sehr variabel und umfasst Hautrötungen (Urtikaria), Verengung der Bronchien (Bronchokonstriktion) sowie im Extremfall den Zusammenbruch des Kreislaufs aufgrund eines anaphylaktischen Schocks. Die Behandlung umfasst, falls möglich, die Unterbrechung der Allergenzufuhr sowie eine aggressive Infusions- und medikamentöse Therapie (Adrenalin, Kortikosteroide, H1- und H2-Antihistaminika). Der auslösende Stoff kann im Nachhinein durch Allergietests (Hauttests, serologische Untersuchungen) identifiziert werden. Die wichtigste prophylaktische Maßnahme ist eine sorgfältige Erhebung der Anamnese vor der Allgemeinanästhesie.[56][57]
Maligne Hyperthermie
Die maligne Hyperthermie ist eine sehr seltene lebensbedrohliche Erkrankung, die als Komplikation einer Allgemeinanästhesie in Erscheinung tritt. Durch die Verabreichung von auslösenden Substanzen (Trigger: Inhalationsanästhetika und das Muskelrelaxans Succinylcholin) wird bei entsprechender genetischer Veranlagung (etwa bei bestimmten Formen von Muskeldystrophie[58]) bei 1:20.000 bis 1:60.000 Narkosedurchführungen eine Stoffwechselentgleisung in der Skelettmuskulatur verursacht.
Die Symptomatik ist sehr variabel und umfasst Muskelstarre, Herzrasen, eine erhöhte Produktion von Kohlenstoffdioxid (CO2) und Temperaturerhöhung bis hin zur Übersäuerung des Körpers sowie Stoffwechsel- und Organversagen, die letztlich zum Tod führen. Durch sofortige Unterbrechung der Inhalationsanästhetikazufuhr und Behandlung mit dem Wirkstoff Dantrolen kann eine maligne Hyperthermie wirksam behandelt werden. Durch die Einführung von Dantrolen konnte in der Vergangenheit die Sterblichkeitsrate stark – auf unter 5 % – gesenkt werden.
Bei Verdacht auf eine Veranlagung zur malignen Hyperthermie stehen der In-vitro-Kontrakturtest sowie molekularbiologische Verfahren zur Verfügung, um diese abzuklären. Die Durchführung einer Allgemeinanästhesie ist in solchen Fällen auch ohne auslösende Substanzen möglich. Wenn für den Eingriff geeignet, können auch Regionalanästhesieverfahren bei Patienten mit MH-Risiko gefahrlos eingesetzt werden.[59][60]
Postoperative Probleme
Postoperative Übelkeit und Erbrechen
Postoperative Übelkeit und Erbrechen sind Nebenwirkungen der Allgemeinanästhesie, die nach dem Erwachen auftreten. Auch im deutschen Sprachraum wird die Abkürzung PONV für das engl. postoperative nausea and vomiting genutzt. Die Häufigkeit (Inzidenz) liegt bei einer üblichen balancierten Anästhesie in einem gemischten Patientenkollektiv bei 20–30 %. Statistische Risikofaktoren für postoperative Übelkeit sind weibliches Geschlecht, das Auftreten bei vorherigen Narkosen oder eine bekannte Neigung zur Reisekrankheit, Nichtraucherstatus sowie ein hoher Bedarf an Opioid-Schmerzmitteln im Anschluss zur Schmerztherapie. Die Therapie besteht aus der Gabe eines einzelnen Antiemetikums oder einer Kombination mehrerer Wirkstoffe. Hierfür kommen Antihistaminika wie beispielsweise Dimenhydrinat, Neuroleptika wie Droperidol, ein 5-HT3-Antagonist, ein Tropan-Alkaloid wie Scopolamin,[61] das Kortikosteroid Dexamethason oder Metoclopramid in Frage, deren Wirksamkeit gut belegt ist. Die Häufigkeit und Intensität von postoperativer Übelkeit und Erbrechen kann prophylaktisch durch die Wahl eines geeigneten Narkoseverfahrens wirksam vermindert werden. So führt die Vermeidung von Inhalationsanästhetika, Lachgas und dafür die Gabe von Propofol im Rahmen einer rein intravenösen Anästhesie wesentlich zur Reduktion von PONV. Wirksam ist auch die risikoadaptierte prophylaktische Gabe von Antiemetika.[62]
Unterkühlung und postoperatives Zittern
Als Postoperatives Zittern (Shivering) bezeichnet man ein unwillkürliches, nicht unterdrückbares Zittern. So versucht der Körper einerseits Wärmeverluste (Hypothermie), die durch den Operationsverlauf entstanden sind, auszugleichen, aber andererseits können auch andere Ursachen für das Zittern verantwortlich sein.[63] Es tritt bei 5–60 Prozent der Patienten auf. Neben subjektivem Unwohlsein können dadurch bei vorerkrankten Patienten Komplikationen des Herz-Kreislaufsystems ausgelöst werden. Die Behandlung erfolgt durch die intravenöse Verabreichung von Clonidin oder des Opioids Pethidin sowie äußere Wärmung. Perioperativ wird, wie bei jeder Anästhesie, auch aus anderen Gründen immer versucht, ein Abfallen der Körpertemperatur zu verhindern. Dies geschieht durch aktives Prewarming vor der Anästhesie und das Anwärmen von Infusionen und Spüllösungen, Wärmeunterlagen und Warmluftgebläse. Ebenso wird bei einer Allgemeinanästhesie nur ein niedriger Frischgasfluss verwendet, um den Wärmeverlust durch die Beatmung zu vermindern. Durch eine Temperatursonde wird die Körperkerntemperatur des Patienten bei Eingriffen über einer halben Stunde Anästhesiedauer überwacht.[64][65]
Störungen der kognitiven Hirnfunktionen
Störungen der Hirnfunktionen nach einer Operation betreffen mehrheitlich ältere Menschen. Dabei wird das postoperative Delirium, das mit Störungen des Bewusstseins, der Aufmerksamkeit und der Orientierung Stunden bis Tage nach dem Eingriff auffällt, von der postoperativen kognitiven Dysfunktion abgegrenzt, bei der nach Tagen/Wochen bis Monaten Probleme der Merk-, Lern- und Konzentrationsfähigkeit auftreten.[66][67][68] Die Ursachen dieser Störungen sind nicht klar, aktuelle Konzepte beschreiben die Entstehung als Summe der äußeren Einflüsse (Operation, Anästhesie, Schmerzen, Auswirkungen von Komplikationen und Vorerkrankungen, fremde Umgebung), bei individueller Resilienz. Die Häufigkeit kognitiver Störungen ist allerdings bei Regionalanästhesieverfahren vergleichbar zur Allgemeinanästhesie.[69][70][71]
Das postoperative Delirium (oder Delir) fällt durch Störungen des Bewusstseins und der Aufmerksamkeit sowie der Wahrnehmung (Gedächtnis, Orientierung) auf. Weiter können psychomotorische Unruhe, Schlafstörungen und Störungen des Denkens (Wahnvorstellungen u. a.) auftreten. Die Symptomatik ist ausgesprochen variabel, auch bei derselben Person im Verlauf. Es wird eine hyperaktive Form, die oft leicht zu erkennen und diagnostizieren ist, von der hypoaktiven Form und einer Mischform unterschieden, die oft nicht erkannt werden. Die Häufigkeit beträgt bei älteren Patienten 5–15 %, nach Hüftoperationen und in der Herzchirurgie liegt sie deutlich höher (bis zu 60 %). Folgen des Deliriums sind ein verlängerter Krankenhausaufenthalt, eine erhöhte Pflegebedürftigkeit sowie eine höhere Sterblichkeit im Verlauf.[66][70]
Narkose in der Tiermedizin
In der Tiermedizin unterscheiden sich Narkosen in einigen Punkten von den in der Humanmedizin durchgeführten. An keiner der fünf tiermedizinischen Ausbildungsstätten in Deutschland gibt es eine eigenständige Abteilung für Veterinäranästhesie, einen entsprechenden Fachtierarzt gibt es nur in wenigen Bundesländern. Bei den meisten operativen Eingriffen ist kein separater Anästhesist zugegen und die Narkose wird vom operierenden Tierarzt selbst eingeleitet und überwacht.[72] Die Pflicht zur Betäubung bei schmerzhaften Eingriffen regelt § 5 des Tierschutzgesetzes. Narkosen können bei Wild- und Zootieren, Hunden und Katzen auch für wenig schmerzhafte Eingriffe wie Röntgenuntersuchungen, das Legen einer Magenschlundsonde, Zahnsteinentfernung, Schur etc. notwendig sein, wenn ein Tier solche Prozeduren nicht toleriert.
Eine Reihe von Faktoren beeinflussen die Durchführung der Allgemeinanästhesie:
- Tierartliche Unterschiede: In der tierärztlichen Praxis werden nicht nur verschiedene Tierarten, sondern Vertreter verschiedener Wirbeltierklassen vorgestellt. Hier gibt es erhebliche Unterschiede in der Physiologie, der Pharmakokinetik der Narkosemittel, der Zugänglichkeit zu Blutgefäßen, der Intubation sowie der Reaktion auf verschiedene Manipulationen. Aber auch innerhalb einer Tierart gibt es zum Teil erhebliche Rasseunterschiede.[72]
- Arzneirechtliche Bestimmungen: Während in der Kleintiermedizin unter bestimmten Voraussetzungen auch humanmedizinische Wirkstoffe eingesetzt werden können (→ Therapienotstand), dürfen bei lebensmittelliefernden Tieren nur für diese Tierarten zugelassene Wirkstoffe eingesetzt werden.
- Technische Voraussetzungen: Narkose- und Überwachungsgeräte sind bei vielen niedergelassenen Tierärzten nicht vorhanden.
- Kosten: Da Tierkranken- oder -operationsversicherungen nur selten vorhanden sind, spielen auch die Kosten eine nicht unwesentliche Rolle. Neben der eigentlichen Narkose wird, sofern sie durchgeführt wird, auch die Überwachung der Vitalfunktionen gesondert nach GOT abgerechnet.
In der Tiermedizin werden häufig Injektionsnarkosen mit Inhalationsnarkosen kombiniert. Dabei werden vorwiegend Mischungen verschiedener Wirkstoffe eingesetzt,[73] am häufigsten die Kombination von Ketamin mit einem Thiazinderivat wie Xylazin (Hellabrunner Mischung) oder Medetomidin (antagonisierbar mit dem α2-Adrenozeptor-Agonisten Atipamezol), sowie Propofol, gegebenenfalls zusätzlich Benzodiazepine und Opioide. Muskelrelaxanzien werden auch in der Tiermedizin verwendet.[72]
Die Inhalationsnarkose wird vor allem bei Vögeln, Heimtieren und Pferden eingesetzt und ist bei längeren Eingriffen und Risikopatienten Mittel der Wahl. Dabei wird überwiegend in Spontanatmung gearbeitet, eine kontrollierte Beatmung wird zumeist nur bei sehr langen Eingriffen, in der Thoraxchirurgie und bei Narkosezwischenfällen durchgeführt. Das einzig zugelassene Inhalationsanästhetikum ist Isofluran.[73][74]
Geschichtliche Aspekte
Siehe auch Anästhesie#Geschichte der Anästhesie
Altertum bis Mittelalter
Erstmals in der Literatur, wohl um 3500 v. Chr., erwähnt findet sich eine „Narkose für chirurgische Zwecke“ (durch einen Gott, der den Menschen Adam in einen tiefen Schlaf habe fallen lassen, um ihm eine Rippe zur Erschaffung Evas als Gefährtin Adams zu entnehmen) in der Bibel (Genesis 2.21), worauf auch der schottische Arzt James Young Simpson hinwies als er 1847 von Calvinisten angefeindet wurde, weil er die Linderung des Geburtsschmerzes mittels des Narkosemittels Chloroform[75] einführte.

Im Alten Ägypten war die einschläfernde und betäubende Wirkung der Alraunenwurzel bekannt. In der griechischen Antike sollen Arzneimittel namens Nepenthes chirurgische Eingriffe ermöglicht haben, wobei es sich um Opium-Zubereitungen gehandelt haben könnte. Die einschläfernde Wirkung der Alraunenwurzel, deren Saft zur Betäubung eingenommen wurde, war im antiken Griechenland allgemein bekannt; die schmerzstillende wurde im 1. Jahrhundert n. Chr. bei Pedanios Dioskurides und Plinius erwähnt.[76][77]
Von dem indischen Arzt Charaka (möglicherweise um 2200 v. Chr.) wurde der Alkoholrausch zur Herbeiführung von Empfindungs- bzw. Schmerzlosigkeit bei Operationen beschrieben.[78] Charaka kannte aber auch die narkotische Wirkung von Eisenhut, Opium und Bilsenkraut.[79][80] Höherprozentige alkoholische Betäubungsmittel standen erst seit der Branntwein-Destillation durch Taddeo Alderotti im 13. Jahrhundert n. Chr. zur Verfügung.
Jahrhundertelang galten größere chirurgische Eingriffe als Maßnahmen in äußersten Notsituationen mit einer hohen Sterblichkeit. Blutung, Infektion und starke Schmerzen schränkten die Anwendung stark ein. Um den Patienten überhaupt operieren zu können, wurde dieser durch Gehilfen oder Fesseln aufwändig fixiert. Im Lauf der Zeit wurden in allen Kulturen zudem Pflanzenextrakte zur Schmerzlinderung verabreicht, etwa von Bilsenkraut, Nieswurz, Schlafmohnkapseln, Hanf und Cocablättern sowie verschiedene alkoholhaltige Getränke.[81] Auch Hippokrates von Kos soll um 450 v. Chr. bereits Inhalationsnarkosen mittels Kräuterdämpfen (etwa durch Einatmen der Verbrennungsdämpfe betäubender Kräuter[82]) durchgeführt haben und vom chinesischen Arzt Bian Que wurde die orale Narkose mittels Weingeist und Hanfextrakt überliefert (Auch der 220 n. Chr. gestorbene chinesische Arzt Hua Tuo nutzte Alkohol mit Hanfextrakt).[83][84]
In der mittelalterlichen Kräutermedizin spielte die Alraune eine besondere Rolle, eine mit Sagen und Mythen in Verbindung gebrachte Pflanze, deren schmerzlindernde Wirkung schon im Altertum beschrieben worden war. Zusammen mit anderen Substanzen (insbesondere Mohnsaft von „schwarzem“ oder „weißem“ Mohn bzw. Opium, Bilsenkraut und Wasserschierling, sowie ab dem 13. Jahrhundert auch „Nieswurz“ und Arsenverbindungen)[85][86] wurde die Alraune seit dem 9. Jahrhundert (wie das von Henry Ernest Sigerist 1923 neu herausgegebene, um 880 oder früher entstandene Bamberger Antidotarium mit dem Rezept Ypnoticum Adiutorium, dessen Herkunft Baur[87] im arabischen oder italienischen Kulturkreis vermutete, belegt) beim zur Narkose benutzten Schlafschwamm (lateinisch Spongia somnifera)[88][89][90] eingesetzt. Solche Schlafschwämmre hielt man, mit den Extrakten durchtränkt, dem Patienten zum „Einatmen“ vor Mund und Nase und dessen Wirkstoffe wurden dann im Verdauungstrakt resorbiert.[91] In einem aus Italien stammenden Codex Monte Cassino (Rezeptsammlung aus dem gleichnamigen Kloster[92]) aus dem 9. Jahrhundert findet sich eine Anweisung, nach der Schwämme in einen Aufguss aus Opium, Stechapfel, Maulbeersaft, Hanf, Mandragora und Eisenhut getaucht und anschließend getrocknet werden, um bei erneuter Anfeuchtung eine Narkose bei dem die Dämpfe daraus Einatmenden zu bewirken.[93] Die narkotische Wirkung beruhte jedoch nicht auf der einfachen Inhalation, sondern auf der Resorption der Wirkstoffe durch Kontakt mit den Schleimhäuten.[94][95] Die Schlafschwamm-Narkose wurde unter anderem auch von dem Salernitaner Arzt Copho[96][97] (11./12. Jahrhundert)[98][99] und Nicolaus von Salerno (im Antidotarium Nicolai, 12. Jahrhundert) sowie von Ugo Borgognoni[100] (genannt auch Hugo von Lucca; frühes 13. Jahrhundert) und dessen Sohn Teodorico Borgognoni (in Cyrurgia), Guy de Chauliac (in Chirurgia magna, 14. Jahrhundert), Heinrich von Pfalzpaint (15. Jahrhundert) und Hans von Gersdorff beschrieben.[101][102] Weitere Methoden der Schmerzlinderung waren das Abbinden von Extremitäten oder eine Kompression der Halsschlagadern, die zur Ohnmacht führte.[103]
Alle diese Methoden, die im Prinzip bis in das 18. Jahrhundert eingesetzt wurden, waren oft mangelhaft in ihrer Wirkung und gefährlich für den Patienten. Bereits der französische Chirurg Guy de Chauliac hatte um 1300 von Komplikationen (Blutandrang, Asphyxie und Tod) nach Verabreichung von Narkosemitteln berichtet.[104] Das Fehlen zuverlässiger Verfahren zur Schmerzausschaltung verhinderte somit die Entwicklung von komplexeren chirurgischen Eingriffen.
Neuzeit
Um 1547 hat Paracelsus bei schmerzhaften Leiden die therapeutische Nutzung von Äther empfohlen. Über eine Anwendung zur Inhalationsanästhesie bei Menschen der von ihm bei Hühnern um 1540 beobachteten einschläfernden Wirkung des von dem Wittenberger Mediziner und Pharmakologen Valerius Cordus hergestellten bzw. als Syntheseprodukt 1546 erstmals[105] beschriebenen Diäthyläthers[106] vor 1841 ist jedoch nichts bekannt. Den Namen Äther erhielt die damals noch „süßes Vitriol“ genannte Substanz erst nach 1729 (ausgehend von dem Spiritus vini aethereus bei dem deutschen Chemiker August Sigmund Frobenius). Dass Ramon Lull bereits im 13. Jahrhundert das Narkosemittel Äther (Schwefel- oder Salpeteräther, oleum vitrioli dulce) in Spanien entdeckt habe, ist aus den Quellen nicht belegbar. Der Italiener Giambattista della Porta publizierte 1562/1589 (De soporiferis medicamentis. In: Magiae naturalis. Band 2, Kapitel 20) über die Schlafschwamm-„Inhalationsanästhesie“ mit verschiedenen einschläfernden Mitteln.[107] Um 1600 soll der Italiener Valverdi durch Kompression der Halsgefäße eine Allgemeinnarkose erzielt haben.[108]
Am 13. Oktober 1804 hatte der japanische Arzt Hanaoka Seishū bei einer Brustkrebsoperation eine Narkose mit einem, den Rezepturen der mittelalterlichen Schlafschwammnarkose vergleichbaren Schlaftrunk durchgeführt.[109]
Bereits im 18. Jahrhundert wurden Substanzen isoliert, die die Grundlage der modernen Anästhesie darstellen. 1772 entdeckte Joseph Priestley das von ihm synthetisierte Lachgas (Distickstoffmonoxid) und 1806 gelang Friedrich Sertürner die Isolation des Morphiums. Obwohl der analgetische Effekt dieser Substanzen erkannt wurde, etwa von Humphry Davy der des von ihm auch zur Behandlung von Zahnschmerzen 1798 (im Pneumatischen Institut) angewendeten und 1800 zur Verwendung bei Operationen von ihm vorgeschlagenen Lachgases, erfolgte keine regelhafte Anwendung in der Medizin.[110][111]
Die Beobachtung, dass in den Blutkreislauf von Hunden eingebrachtes Opium, diese betäuben kann, machte erstmals der Erfinder der intravenösen Injektion, der englische Astronom und Architekt Christopher Wren, im Jahr 1656, worüber H. Oldenburg 1665 berichtete.[112] Im Jahr 1664 beschrieb Johann Sigismund Elsholtz in Clysmatica nova die intravenöse Narkosetechnik mit Opiumextrakt.[113] Zu den Pionieren der intravenösen Anästhesie bzw. intravenösen Narkose gehört vor allem der Chirurg und Physiologe Pierre-Cyprien Oré (1828–1889) in Bordeaux, der mit einer Modifikation der Spritze von Pravaz erstmals 1872 das von Oskar Liebreich 1869 eingeführte Chloralhydrat als intravenöses Anästhetikum zu Narkosezwecken bei Menschen einsetzte.[114][115][116]
Henry Hill Hickman (1800–1830) aus Shifnal in Shropshire[117] konnte 1824 zeigen, dass eingeatmetes Kohlendioxid in die Blutbahn gelangt und legte damit den wissenschaftlichen Grundstein für die moderne Inhalationsnarkose,[118] allerdings fanden seine Arbeiten über die physiologischen Vorgänge während einer Narkose kein Interesse. Bereits ab 1820 hatte er mit Tieren experimentiert, die er, nachdem er sie hat Kohlendioxid inhalieren lassen, schmerzlos operieren konnte.[119]
Entstehung der modernen Allgemeinanästhesie

Im Januar 1842 verabreichte in den USA der Chemiestudent William E. Clarke (1819–1898) einem Patienten des Zahnarztes Elijah Pope Äther zur Schmerzstillung bei einer Zahnextraktion.[121][122] Äther zur Schmerzausschaltung bei chirurgischen Eingriffen hatte am 30. März 1842 auch der Arzt Crawford Williamson Long eingesetzt und einem Patienten einen Tumor am Nacken schmerzfrei entfernt, wobei er zur Narkotisierung ein mit Äther getränktes Handtuch verwendete. Er unterließ aber eine Publikation. Horace Wells, Zahnarzt aus Hartford (Connecticut), USA, beobachtete am 10. Dezember 1844 die schmerzstillende Wirkung von Lachgas zufällig bei einer durch Gardner Quincy Colton[123] erfolgten Anwendung zur Unterhaltung des Publikums, wie sie damals auf Jahrmärkten üblich war. Er setzte es ab dem Jahr 1844 erfolgreich bei Zahnextraktionen ein, eine öffentliche Vorführung 1845 am Massachusetts General Hospital in Boston misslang jedoch, der Patient schrie vor Schmerzen.[124][125]
Als Geburtsstunde der modernen Anästhesie gilt heute der 16. Oktober 1846, an dem der amerikanische Zahnarzt William Thomas Green Morton, nachdem er von Charles Thomas Jackson[126] auf die Möglichkeit der Narkose mittels Schwefeläther aufmerksam gemacht worden war, am Massachusetts General Hospital der Harvard-Universität (Boston) durch das Einatmenlassen von Ätherdämpfen (Diethylether) die Entfernung eines Hämangioms am Hals des Patienten Gilbert Abbot ermöglichte („Äthertag von Boston“). Auch wenn der Patient sich während des Eingriffes bewegte und Geräusche von sich gab, konnte er sich jedoch nicht an den Eingriff erinnern und gab keine Schmerzen an, so dass die Durchführung als gelungen betrachtet wurde. Morton wird deshalb die erste öffentlich dokumentierte Durchführung einer Allgemeinanästhesie zugeschrieben. Der vorsitzende Chirurg John Collins Warren ließ sich bei der Durchführung zu den Worten “Gentlemen, this is no humbug!” hinreißen.[124][125][127]
In der Folge breitete sich das Interesse an dem neuen Verfahren rasch in der wissenschaftlichen Welt aus, was vor allem den Veröffentlichungen von Henry Jacob Bigelow zu verdanken ist. Viele skeptische Chirurgen äußerten sich jedoch kritisch, sie betrachteten die „Yankee-Erfindung“ als „Windbeutelei“ und „Verbrüderung mit der Quacklaberei“ und fanden, dass „… der Äther, der den Schmerz tötet, auch das Leben töte“. Die Befürworter der Anästhesie setzten sich jedoch durch und das Wissen über die Narkoseführung breitete sich von England ausgehend in den nächsten Jahren auch rasch in Europa aus.[128]
Die erste erfolgreiche Äthernarkose in Deutschland wurde am 24. Januar 1847 durch Heinrich E. Weikert und Carl F. E. Obenaus in Leipzig durchgeführt.[124]
In den folgenden Jahrzehnten wurden neben dem Äther weitere Narkotika wie Lachgas und das seit 1831 bekannte und 1847 von James Young Simpson als Anästhetikum eingeführte Chloroform eingesetzt. Dazu wurden die verschiedensten Gerätschaften zu Applikation der Stoffe entwickelt, von Tropf-Masken (wie der aus hygienischen Überlegungen im Rahmen der Aseptik entwickelten und 1890 als Äthertropfmaske (zur Äthertropfnarkose) eingeführten Schimmelbusch-Maske mit Drahtgeflecht und Gaze[129]) bis zu den ersten einfachen Narkosegeräten.[130] Weitere neu eingeführte Narkosemittel waren 1848 – als Kompromiss zwischen dem zu dieser Zeit für gefährlicher gehaltenen Äther und Chloroform – die Alkohol-Chloroform-Äthermischung (ACE, bestehend aus einem Teil Alkohol, zwei Teilen Chloroform und drei Teilen Äther) des bis 1847 37 verschiedene Substanzen wie Chloräthyl und Bromäthyl, als mögliche Alternativen für Äther und Chloroform, untersuchenden Engländers Thomas Nunneley und das von Nunneley untersuchte und von Heyfelder verwendete Chloräthyl. Nunneley hatte auch das von ihm bei Augenoperationen verwendete Bromäthyl vorgeschlagen. Um 1890 bis 1910 wurden verschiedene Statistiken und Untersuchungen vorgelegt, die zeigten, dass Chloroform häufiger tödliche Zwischenfälle[131] nach sich zog als Äther.[132] Das von dem österreichischen Chemiker August Freund 1882 entdeckte Cyclopropan wurde nach der im November 1928[133] in den USA erfolgten Einführung in die Anästhesie durch den Chemiker George H. W. Lucas, unterstützt durch den kanadischen Pharmakologen Velyien E. Henderson (1877–1945), ebenfalls (bei Menschen erstmals 1930 durch Ralph M. Waters und Erwin R. Schmidt,[134] die diese Anwendung durch ihre 1934 publizierte Veröffentlichung[135] einführten) eine Zeitlang als Narkotikum eingesetzt. Isopropylchlorid wurde seit seiner Einführung durch Hans Killian ab 1939 benutzt. Das dem Chloroform ähnliche Trilen (Trichloräthylen)[136] fand ab 1941, eingeführt in England von C. Langton Hewer, für einige Jahre häufig Verwendung neben Lachgas.[137]
Zu den Grundlagen der kontrollierbaren Narkosemittelgabe über die Atemwege gehören ein in England von James Watt 1795 für Thomas Beddoes[138] entworfene Gasinhalator und der von Humphry Davy konstruierte und 1799 vorgestellte Lachgas-Inhalierapparat.[139]
Die von dem russischen Chirurgen Nikolai Pirogoff 1847 beschriebene, über den Mastdarm zu verabreichende rektale Ätheranästhesie[140] hat sich nicht durchgesetzt.
Methoden der Atemwegssicherung wie die in Großbritannien (1858 im Tierversuch durch John Snow, dem am Kaninchen die erste Intubationsnarkose überhaupt gelang) und USA entwickelte[141] und in Deutschland 1869 erstmals am Menschen durch Friedrich Trendelenburg (wie Snow über eine Tracheotomie, jedoch mit Abdichtung der Luftröhre durch eine aufblasbare Manschette, wodurch im Rahmen einer Mundhöhlenoperation die Aspiration von Blut vermieden werden sollte – ähnlich wie beim 1898 von Viktor Eisenmenger erstmals[142] beschriebenen und den heutigen Endotrachealtuben vergleichbaren halbsteifen Trachealtubus mit aufblasbarer Gummimanschette) durchgeführte endotracheale Intubation ermöglichten eine vollständige Übernahme der Atemfunktion und über die intratracheale bzw. endotracheale Insufflation eine genaue Dosierung von Narkosegasen.[143] Der Schotte William Macewen etablierte 1878 die perorale (über den Mund durchgeführte) Einführung des Beatmungsschlauches (Tubus). Die Intubationsnarkose (früher auch intratracheale Narkose oder Intratrachealnarkose genannt)[144] war Voraussetzung für die Entwicklung von Eingriffen in den Körperhöhlen, deren Durchführung sonst kaum möglich ist. Eine direkte Sicht auf den Kehlkopf bei der endotrachealen Intubation ermöglichte erstmals das 1895 von dem deutschen Hals-Nasen-Ohrenarzt Alfred Kirstein konstruierte Laryngoskop.[145] Ein Verfahren mit Verwendung eines dünnen Katheters, der in die Trachea eingeführt wird und über den das Narkosegas in die Lungen strömt, wurde 1907 von Barthelémy und Dufour vorgestellt. Es war ab 1913, nachdem die amerikanischen Physiologen Samuel J. Meltzer und John Auer 1910 dargestellt hatten, dass (wie bei der späteren Jet-Ventilation) bei genügend hohem Gasfluss im Tierversuch sowohl die Versorgung mit Sauerstoff gewährleistet ist als auch ein Kollaps der Lungen vermieden wird, als Insufflationsnarkose in den USA und Europa verbreitet. Insbesondere die Anästhesisten Ivan W. Magill und E. S. Rowbotham stellen aufgrund ihrer Erfahrungen während des Zweiten Weltkriegs fest, dass aus atemmechanischen Gründen der Verwendung eines weiten Tubus der Vorzug zu geben ist, was in der Folgezeit dann auch die weitere Entwicklung zeigte.[146] Ein Pionier der Intubationsnarkose in Deutschland war der Kasseler Chirurg Franz Kuhn, der zwischen 1910 und 1913 Spiraltuben aus Metall mit Hilfe eines Mandrins bei noch wachen Patienten einführte.[147]
Entwicklungen im 20. Jahrhundert
Im 20. Jahrhundert wurde eine Vielzahl von technischen Verfahren und Vorgehensweisen entwickelt, die die Durchführung einer Allgemeinanästhesie zu einem weitgehend sicheren Routineeingriff machten. In ihrer Gesamtheit ermöglichen sie Operationen, die heute chirurgische Routine sind, jedoch mit einer einfachen Äther-Tropfanästhesie noch nicht möglich waren.
Zur Vermeidung oder Reduzierung von unerwünschten Nebenwirkungen einer Narkose erhalten Patienten vor der Narkose meist eine Prämedikation. Begonnen hatte diese Art der Vorbehandlung etwa im Jahr 1900 als der deutsche Arzt Schneiderlein erstmals die Gabe von Morphin und Scopolamin hierzu vorschlug (Die Kombination von Morphin und Scopolamin wurde 1916[148] von Elisabeth Bredenfeld in der Schweiz auch für die intravenöse Narkosetechnik eingeführt[149]).
Eine der ersten wissenschaftlichen Theorien über die Wirkungsweise von Narkotika und auch ein Schritt in Richtung der modernen Anästhesiologie war die 1901 aufgestellte Lipidtheorie von Hans Horst Meyer und Ernst Overton.[150]
Ab 1923 (W. E. Brown[151]) wurde eine Zeitlang das im 18. Jahrhundert entdeckte Ethen und 1918 von Arno B. Luckhardt[152] als anästhestisch wirksam erkannt zur Äthylennarkose eingesetzt. Ebenfalls 1923 führten der Würzburger Frauenarzt Carl Joseph Gauß und der Heidelberger Pharmakologe Hermann Wieland (1885–1929) die Narcylennarkose unter Verwendung von Ethin ein.[153] Beide Substanzen wurden inhaliert.
Zur intravenösen Einleitung einer Narkose wurden seit Beginn des 20. Jahrhunderts Schlafmittel aus der Gruppe der Barbiturate[154] eingesetzt. Das erste Barbiturat, Veronal war nach Synthese durch den deutschen Chemiker und Nobelpreisträger Emil Fischer ab 1903 verfügbar. Der deutsche Arzt Hellmut Weese führte 1932 das Barbiturat-Präparat Evipan zur Narkose ein.[155] Nicht durchgesetzt hat sich die von Ludwig Burkhardt 1909[156] in Würzburg erstmals erfolgreich angewendete intravenöse Äthernarkose[157][158] und auch das 1890 von Heinrich Dreser in München als hypnotisch wirkende Substanz nachgewiesen und 1909 erstmals benutzte intravenöse Narkotikum Hedonal, das die Russen Nicholas P. Krakow[159] and Sergei Fedoroff ab 1905 empfohlen hatten,[160] ist ebenso wie das 1926 durch den Chirurgen Otto Butzengeiger[161] und Fritz Eichholtz eingeführte Avertin und das von Richard Bumm 1927 als intravenöses Narkotikum vorgestellte Pernocton,[162] das sich jedoch zur intravenösen Einleitung der Äthertropfnarkose und zur Erzeugung eines Dämmerschlafes bewährt[163] hatte, wieder vom Markt verschwunden.[164] Im Jahr 1913 publizierten Noel und Soutarr narkotische Effekte von intravenös verabreichtem Paraldehyd.[165] Zu den ersten kurzwirksamen intravenösen Narkotika gehörte das 1963 von R. Hiltmann, H. Wollweber, W. Wirth und F. Hoffmeister in Deutschland vorgestellte Propanidid (Epontol).[166] Im Jahr 1996 wurde Remifentanil in Deutschland eingeführt.[167] Die zur Narkoseeinleitung benutzten kurzwirksamen Barbiturate wie zuletzt Methohexital wurden abgelöst durch von barbituratfreien Mitteln. So ab 1973 von dem Imidazolderivat Etomidat und ab 1977 dem Phenolderivat Propofol.[168]
Ab 1910 stand ein von Maximilian Neu, unter Mitwirkung von Rudolf Gottlieb und Walter Madelung in Deutschland für die Narkose entwickeltes modernes Gasmischgerät, ein Lachgas-Sauerstoff-Narkoseapparat mit Rotameter, zur Verfügung und 1914 hatte Richard Foregger einen Narkoseapparat mit Flowmeter (ein Wasser-Durchströmungsmesser) konstruiert. Zur Entfernung des im Narkosesystem pendelnden oder im „Kreisteil“ zirkulierenden, vom Patienten abgeatmeten Kohlendioxids verwendete erstmals Dennis E. Jackson (1878–1980)[169] 1915 den zu jedem heute üblichen Narkosegerät (und auch zu Kreislauftauchgeräten) gehörenden Kohlensäureabsorber. Einen Lachgas-Sauerstoff-Äther-Narkoseapparat konstruierte (Henry) Edmund Boyle[170] (1875–1941) 1917 in England. Im Jahr 1924 stellte Ralph M. Waters ein „Pendelsystem“ und 1930 wurde ein ab 1928 konstruiertes „Kreissystem“ von Brian C. Sword und Richard von Foregger bekannt gemacht.[171][172] Die erste permanente Narkoseanlage Deutschland hatte Hans Killian an der Universitätsklinik von Freiburg im Breisgau konstruiert und dort mit Gastanks, Sauerstoff, Kohlendioxid und Drillingssaugpumpe einbauen lassen.[173]
Die Narkosegeräte zur Beatmung und Verabreichung von Anästhetika über die Atemwege wurden von einfachen Tropfmasken bis hin zu den heute üblichen Rückatemgeräten mit Kreisteil entwickelt. In diesen zirkuliert die Atemluft zwischen Gerät und Patient, während nur eine geringe Menge Frischgas zugegeben wird, was Wärme- und Flüssigkeitsverluste und den Narkosegasverbrauch reduziert. Die Überwachung, die anfangs nur aus einfachem Pulstasten bestand, schließt heute eine Vielzahl von Parametern ein.
Während die (im Allgemeinen über den Mund oder seltener die Nase erfolgende) Intubation sich in den Vereinigten Staaten und im Vereinigten Königreich rasch etablierte, nachdem die endotracheale Narkose (Intubationsnarkose) von Ivan Magill und Stanley Rowbotham[174] (1890–1979) 1920 auf breiter Basis eingeführt[175] worden war, wurde sie in Kontinentaleuropa anfangs kritisch betrachtet. Trotz wissenschaftlichen Fürsprechern wie Franz Kuhn, der 1905, nachdem er die endotracheale Narkose systematisch ausgearbeitet hatte, eine Apparatur zur im Gegensatz zum Unterprinzip sich im 20. Jahrhundert durchsetzenden Überdruckbeatmung entwickelt[176] und bereits 1911 seine Monografie über die perorale Intubation[177] publiziert hatte, wurde sie unter anderem von Chirurgen wie Ferdinand Sauerbruch energisch abgelehnt, was dazu führte, dass in der Folge die angelsächsischen Länder die moderne Anästhesie federführend entwickelten.[178]
Eine im Rahmen von Narkosen (beim Einführen des Beatmungstubus und vielen Operationen, vor allem bauchchirurgischen Eingriffen) häufig notwendige vollständige Muskelentspannung wird in der modernen Anästhesthie durch Verwendung bestimmter, über die Vene verbabreichter Medikamente ermöglicht. Nachdem bereits 1910 Arthur Läwen seine ersten klinischen Versuche zur Anwendung von Curare gemacht hatte und dieses Muskelrelaxans am 23. Januar 1942 mit der Anwendung von Tubocurare (im Präparat Intocostrin der Firma Squibb) bei einer Appendektomie unter Cyclopropannarkose am Homoepathic Hospital of Montreal von den kanadischen Anästhesisten Harold R. Griffith und G. Enid Johnson[179] in die klinische Praxis eingeführt worden war,[180][181] entdeckte der schweizerisch-italienische Pharmakologe Daniel Bovet zwischen 1946 und 1950 auch die muskelrelaxierende Wirkung von Flaxedil (Gallamin) und dem noch heute verwendeten Succinylcholin[182] (1951 entwickelten Franz Theodor von Brücke, Otto Mayrhofer und M. Hassfurther in Österreich die Muskelrelaxation mit Succinylcholinchlorid und S. Thesleff in Schweden Succinylcholinjodid).[183] Im Jahr 1992 wurde Mivacurium, das erste für die klinische Anwendung zugelassene kurzwirkende nicht depolarisierende Muskelrelaxans, eingeführt.[184] Rocuronium wurde 1995 eingeführt, etwa ein Jahr darauf Cis-Atracurium.[185]
Das im Vergleich zu Äther, Chloroform und anderen Substanzen Vorteile bietende Inhalationsanästhetikum Halothan wurde durch Charles Suckling, J. Raventós[186] und Michael Johnstone in England synthetisiert, pharmakologisch erprobt und am 20. Januar 1956 von Johnstone in Manchester erstmals klinisch angewendet. Als weiteres Inhalationsnarkotikum wurde 1960 in den USA Methoxyfluran (Penthrane) durch J. F. Artusio und A. Van Poznak bekanntgemacht.[187] Später kamen Sevofluran (Japan, 1990; ab 1996 auch in Deutschland), Desfluran (USA, 1991; ab 1995 auch in Deutschland) hinzu.[188]
Statt der eine im Allgemeinen eine tiefe Narkose bewirkenden Inhalationsanästhesie wurde in Belgien durch Paul Mundeleer und Joris de Castro 1959 zur Vermeidung potentieller unerwünschter Wirkungen der reinen Inhalationsnarkose die Neuroleptanalgesie eingeführt. Hierbei werden ein Neuroleptikum und ein starkes Schmerzmittel gespritzt. Die Anwendung von Ketamin, das bei Erzeugung einer sogenannten dissoziativen Anästhesie die Schutzreflexe weitgehend bestehen lässt, ist seit ihrer Einführung (etwa als Ketalar) durch G. Chen, G. Corssen und E. F. Domino 1965 Bestandteil des anästhesiologischen Repertoires.[189]
Die Anästhesie-Durchführung (als Narkotiseure wirkten um 1920 – so im Juliusspital Würzburg – beispielsweise Kapläne[190]) erlebte in der zweiten Hälfte des 20. Jahrhunderts im Rahmen der Etablierung des Fachgebietes Anästhesiologie eine Professionalisierung. Zusammen mit einer Vielzahl von technischen Entwicklungen und deren routinemäßigem klinischen Einsatz (empfindliche Überwachungsverfahren wie Pulsoxymetrie und Kapnometrie, kurzwirksame und gut steuerbare Anästhetika, vielfältige Instrumente zur Bewältigung der schwierigen Atemwegssicherung) und der Etablierung von Richtlinien, Algorithmen, Simulatortraining, Checklisten etc. erreichte die Allgemeinanästhesie ihren heutigen Status als relativ risikoarmes Routineverfahren.
Literatur
- M. von Brunn: Die Allgemeinnarkose. Ferdinand Enke, Stuttgart 1913.
- Ernst Darmstaedter: Zur Geschichte der Narkose und Anästhesie. In: Schmerz, Narkose und Anästhesie. Band 4, 1931/1932, S. 117 ff.
- B. M. Duncum: The development of inhalation anaesthesia. Oxford University Press, London 1947.
- Hans Killian (geplant mit Hellmut Weese): Die Narkose. Thieme, Stuttgart 1954.
- Georg Laux: Allgemeinanästhesie. In: R. Rossaint, C. Werner, B. Zwißler (Hrsg.): Die Anästhesiologie. Allgemeine und spezielle Anästhesiologie, Schmerztherapie und Intensivmedizin. 2. Auflage. Springer, Berlin 2008, ISBN 978-3-540-76301-7, S. 593–614.
- H. D. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32.
- Hans Walter Striebel: Die Anästhesie: Grundlagen und Praxis. 2. Auflage. Schattauer, 2010, ISBN 978-3-7945-2636-9.
- Ludwig Brandt: Illustrierte Geschichte der Anästhesie. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1997, ISBN 3-8047-1501-X.
- Richard J. Kitz, Leroy D. Vandam: A History and the Scope of Anesthetic Practice. In: Ronald D. Miller (Hrsg.): Anesthesia. Band 1. 2. Auflage. Churchill Livingstone, New York / Edinburgh / London / Melbourne 1986, ISBN 0-443-08328-2, S. 3–25.
- F. v. Winkel: Zur Geschichte der Betäubungsmittel für schmerzlose Operationen. München 1902.
Weblinks
- Literatur von und über Narkose im Katalog der Deutschen Nationalbibliothek
- Ulf Glade: Geschichte der Anästhesie. Die Geschichte der Anästhesie von der Antike bis in das Jahr 2000. ulfglade.wordpress.com
Einzelnachweise
- ↑ Friedrich Kluge, Alfred Götze: Etymologisches Wörterbuch der deutschen Sprache. 20. Auflage. Hrsg. von Walther Mitzka. De Gruyter, Berlin / New York 1967; Neudruck („21. unveränderte Auflage“) ebenda 1975, ISBN 3-11-005709-3, S. 503.
- ↑ Martin Kirschner: Eine psycheschonende und steuerbare Form der Allgemeinbetäubung. Der Chirurg. Band 1, 1929, S. 673 ff.
- ↑ M. Meyer, Manfred Schädlich (Hrsg.): Allgemeine Anästhesie. VEB-Verlag Volk und Gesundheit, Berlin 1983, DNB 831153202
- ↑ Vgl. W. B. Müller: Narkologie. Berlin 1908.
- ↑ Kluge: Etymologisches Wörterbuch der deutschen Sprache. 24. Auflage
- ↑ a b B. W. Urban, M. Bleckwenn: Concepts and correlations relevant to general anaesthesia. In: Br J Anaesth. Band 89, Nr. 1, Jul 2002, S. 3–16. (Review: PMID 12173238)
- ↑ a b c H. A. Adams, E. Kochs, C. Krier: Heutige Anästhesieverfahren – Versuch einer Systematik. In: Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 36, 2001, S. 262–267. doi:10.1055/s-2001-14470. PMID 11413694.
- ↑ I. Rundshagen: Intraoperative Wachheit. In: Anästh Intensivmed. 2009 50, S. 296–308. Review.
- ↑ a b Continuum of depth of sedation, definition of general anesthesia, and levels of sedation/analgesia. American Society of Anesthesiologists Standards, Guidelines, and Statements, October 27, 2004.
- ↑ G. H. Montgomery, D. David, G. Winkel, J. H. Silverstein, D. H. Bovbjerg: The effectiveness of adjunctive hypnosis with surgical patients: a meta-analysis. In: Anesth Analg. Band 94, Nr. 6, Jun 2002, S. 1639–1645. PMID 12032044.
- ↑ A. H. Wobst: Hypnosis and surgery: past, present, and future. In: Anesth Analg. Band 104, Nr. 5, Mai 2007, S. 1199–1208. Review. PMID 17456675.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 23.
- ↑ Otto Mayrhofer: Gedanken zum 150. Geburtstag der Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 881–883, hier: S. 882.
- ↑ Richard J. Kitz, Leroy D. Vandam: A History and the Scope of Anesthetic Practice. In: Ronald D. Miller (Hrsg.): Anesthesia. 2. Auflage. Band 1, 1986, ISBN 0-443-08328-2, S. 4–8 (The Rise of Inhalation Anesthesia).
- ↑ H. W. Striebel: Die Anästhesie: Grundlagen und Praxis. 2010, S. 108–203.
- ↑ N. P. Franks: Molecular targets underlying general anaesthesia. In: British Journal of Pharmacology. Band 147, Supplement 1, Januar 2006, S. S72–S81. Review. PMID 16402123.
- ↑ V. S. Eckle, C. Hucklenbruch, S. M. Todorovic: Was wissen wir über Narkosemechanismen? Bewusstlosigkeit, Bewegungslosigkeit und Amnesie. In: Anaesthesist. Band 58, Nr. 11, November 2009, S. 1144–1149. PMID 19760252. PMC 2823130 (freier Volltext)
- ↑ a b K. Ellinger, P. M. Osswald, H. Genzwürker (Hrsg.): Kursbuch Notfallmedizin. Deutscher Ärzte-Verlag, 2007, ISBN 978-3-7691-0519-3, S. 623ff.
- ↑ a b Ausstattung des anästhesiologischen Arbeitsplatzes. Fortschreibung der Richtlinien der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin und des Berufsverbandes Deutscher Anästhesisten. In: Anästh Intensivmed. Band 36, 1995, S. 250–254.
- ↑ W. Buhre, R. Rossaint: Perioperative management and monitoring in anaesthesia. In: Lancet. Band 362, Nr. 9398, 29. November 2003, S. 1839–1846. Review. PMID 14654324.
- ↑ Standards for basic anesthetic monitoring. American Society of Anesthesiologists, 25. Oktober 2005.
- ↑ Zulässigkeit und Grenzen der Parallelverfahren in der Anästhesiologie („Münsteraner Erklärung II 2007“). In: Anästh Intensivmed. 2007;48:000-000 (Volltext)
- ↑ M. Andreas: Delegation ärztlicher Tätigkeiten auf nichtärztliches Personal. In: Anästhesiol Intensivmed. Band 11, 2008, S. 593–601.
- ↑ B. Zwissler u. a.: Präoperative Evaluation erwachsener Patienten vor elektiven, nicht kardiochirurgischen Eingriffen. DGAInfo; Supplement Nr. 8 – 2010. Gemeinsame Empfehlung der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin, der Deutschen Gesellschaft für Innere Medizin und der Deutschen Gesellschaft für Chirurgie. In: Anästh Intensivmed. Band 11, 2010, S. 788–796.
- ↑ R. Rossaint, C. Werner, B. Zwißler (Hrsg.): Die Anästhesiologie. Allgemeine und spezielle Anästhesiologie, Schmerztherapie und Intensivmedizin. 2. Auflage. Springer, Berlin 2008, ISBN 978-3-540-76301-7, S. 1720–1726.
- ↑ A. Ng, G. Smith: Gastroesophageal reflux and aspiration of gastric contents in anesthetic practice. In: Anesth Analg. Band 93, Nr. 2, Aug 2001, S. 494–513. Review. PMID 11473886.
- ↑ Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin (DGAI) und Berufsverband Deutscher Anästhesisten (BDA): Präoperatives Nüchternheitsgebot bei elektiven Eingriffen. In: Anaesthesiol Intensivmed. Band 45, 2004, S. 722.
- ↑ American Society of Anesthesiologists Task Force on Preoperative Fasting: Practice guidelines for preoperative fasting and the use of pharmacologic agents to reduce the risk of pulmonary aspiration: application to healthy patients undergoing elective procedures. In: Anesthesiology. Band 90, 1999, S. 896–905.
- ↑ a b c G. Weiß, M. Jacob: Präoperative Nüchternheit 2008. In: Anaesthesist. Band 57, 2008, S. 857–872 (Review).
- ↑ Stellungnahme zur präoperativen Nikotinkarenz* K. Waurick, H. Van Aken: Beschluss des Engeren Präsidiums der DGAI vom 7. März 2013. In: Anästhesiologie & Intensivmedizin. Band 54, 2013, S. 488 (Aktiv Druck & Verlag)
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 26.
- ↑ D. Steinmann, H. J. Priebe: Krikoiddruck. In: Anaesthesist. Band 58, Nr. 7, Jul 2009, S. 695–707. Review. PMID 19554271; dazu: A. Timmermann, C. Byhahn: Krikoiddruck: Schützender Handgriff oder etablierter Unfug? (Editorial). In: Anaesthesist. Band 58, Nr. 7, Jul 2009, S. 663–664. PMID 19547935.
- ↑ D. T. Neilipovitz, E. T. Crosby: No evidence for decreased incidence of aspiration after rapid sequence induction. In: Can J Anaesth. Band 54, Nr. 9, Sep 2007, S. 748–764. Review. PMID 17766743.
- ↑ Symposium: Der Atemweg (PDF; 6,0 MB)
- ↑ A. Jacomet, T. Schnider: Obligate Maskenbeatmung vor Relaxation. Wo ist die Evidenz? In: Anaesthesist. Band 61, Nr. 5, Mai 2012, S. 401–406. doi:10.1007/s00101-012-2032-2. PMID 22576995.
- ↑ Probebeatmung vor Relaxation; Sicherheit oder veraltete Denkweise (PDF; 1,5 MB)
- ↑ a b c Airway Management. Leitlinie der Deutschen Gesellschaft für Anästhesiologie und Intensivmedizin. In: Anästh Intensivmed. Band 45, 2004, S. 302–306.
- ↑ a b O. Langeron, J. Amour, B. Vivien, F. Aubrun: Clinical review: management of difficult airways. In: Crit Care. Band 10, Nr. 6, 2006, S. 243. Review. PMID 17184555.
- ↑ G. N. Schmidt, J. Müller, P. Bischoff: Messung der Narkosetiefe. In: Anaesthesist. Band 47, Nr. 1, Januar 2008, S. 9–30 und 32–36. Review: PMID 18209969
- ↑ Empfehlungen zur Überwachung nach Anästhesieverfahren. – BDA/DGAI (PDF; 54 kB). In: Anästh Intensivmed. Band 50, 2009, S. S485–S488
- ↑ Standards for postanesthesia care. American Society of Anesthesiologists, 27. Oktober 2004.
- ↑ J. M. Hunter: The recovery period. In: Br J Anaesth. Band 95, Nr. 1, Jul 2005, S. 1–2. PMID 15941733.
- ↑ R. R. Macintosh: Deaths under anaesthetics. In: British Journal of Anaesthesiology. Band 21, Nr. 3, Januar 1949, S. 107–136. PMID 18115864.
- ↑ a b c A. Gottschalk, H. von Aken, M. Zenz, T. Standl: Ist Anästhesie gefährlich? In: Dtsch Arztebl Int. Band 108, Nr. 27, 2011, S. 469–474. PMID 21814522
- ↑ a b c d L. G. Braz, D. G. Braz, D. S. da Cruz, L. A. Fernandes, N. S. Módolo, J. R. Braz: PMC 2763076 (freier Volltext) Mortality in anesthesia: a systematic review. In: Clinics. (Sao Paulo). Band 64, Nr. 10, 2009, S. 999–1006. PMID 19841708.
- ↑ a b c R. S. Lagasse: Anesthesia safety: model or myth? A review of the published literature and analysis of current original data. In: Anesthesiology. Band 97, Nr. 6, Dez 2002, S. 1609–1617. Review. PMID 12459692
- ↑ a b c A. Lienhart, Y. Auroy, F. Péquignot, D. Benhamou, J. Warszawski, M. Bovet, E. Jougla: Survey of anesthesia-related mortality in France. In: Anesthesiology. Band 105, Nr. 6, Dez 2006, S. 1087–1097. PMID 17122571.
- ↑ M. S. Arbous, D. E. Grobbee, J. W. van Kleef, J. J. de Lange, H. H. Spoormans, P. Touw u. a.: Mortality associated with anaesthesia: a qualitative analysis to identify risk factors. In: Anaesthesia. Band 56, Nr. 12, 2001, S. 1141–1153. PMID 11736769.
- ↑ Y. Kawashima, S. Takahashi, M. Suzuki, K. Morita, K. Irita, Y. Iwao, N. Seo, K. Tsuzaki, S. Dohi, T. Kobayashi, Y. Goto, G. Suzuki, A. Fujii, H. Suzuki, K. Yokoyama, T. Kugimiya: Anesthesia-related mortality and morbidity over a 5-year period in 2,363,038 patients in Japan. In: Acta Anaesthesiol Scand. Band 47, Nr. 7, Aug 2003, S. 809–817. PMID 12859300
- ↑ H. W. Striebel: Die Anästhesie: Grundlagen und Praxis. 2010, S. 804 f.
- ↑ H. W. Striebel: Die Anästhesie: Grundlagen und Praxis. 2010, S. 802 f.
- ↑ H. Metzler, K. Huber, S. Kozek-Langenecker, M. N. Vicenzi, A. Münch: Koronare Stents, duale Antiplättchentherapie und die perioperative Problematik. In: Anaesthesist. Band 56, Nr. 4, Apr 2007, S. 401–410. Review. PMID 17396240.
- ↑ a b c U. Linstedt, H. Wulf: EEG-Messung zur Awareness-Vermeidung – Nutzen oder Luxus? In: Anasthesiol Intensivmed Notfallmed Schmerzther. Band 43, Nr. 5, Mai 2008, S. 384–391. PMID 18464217
- ↑ a b c B. A. Orser, C. D. Mazer, A. J. Baker: Awareness during anesthesia. In: CMAJ. Band 178, Nr. 2, 15. Januar 2008, S. 185–188. Review. PMID 18073268, PMC 2175003 (freier Volltext)
- ↑ Practice Advisory for Intraoperative Awareness and Brain Function Monitoring. A Report by the American Society of Anesthesiologists Task Force on Intraoperative Awareness. In: Anesthesiology. Band 104, 2006, S. 847–864. PMID 16571982
- ↑ D. L. Hepner, M. C. Castells: Anaphylaxis during the perioperative period. In: Anesth Analg. Band 97, Nr. 5, November 2003, S. 1381–1395. Review. PMID 14570656.
- ↑ P. M. Mertes, M. C. Laxenaire: Allergy and anaphylaxis in anaesthesia. In: Minerva Anestesiol. Band 70, Nr. 5, Mai 2004, S. 285–291. Review. PMID 15181405
- ↑ V. Schneider, Klaus Eyrich, J. Stelzner: Die Muskeldystrophie als Anästhesie-Risiko. In: Versicherungsmedizin. Band 44, 1993, S. 133–137.
- ↑ H. Rosenberg, M. Davis, D. James, N. Pollock, K. Stowell: Malignant hyperthermia. In: Orphanet J Rare Dis. Band 2, 24. Apr 2007, Artikel 21. Review. PMID 17456235.
- ↑ Empfehlung zur Therapie der malignen Hyperthermie. Beschluss des Engeren Präsidiums der DGAI. (revidierte Version 2008) (PDF, 108 kB)
- ↑ Robert M. Knapp: Prophylaxis for PONV. etherweb.bwh.harvard.edu (PDF; 7,1 MB).
- ↑ D. Rüsch, L. H. Eberhart, J. Wallenborn, P. Kranke: Übelkeit und Erbrechen nach Operationen in Allgemeinanästhesie: Eine evidenzbasierte Übersicht über Risikoeinschätzung, Prophylaxe und Therapie. In: Dtsch Arztebl Int. Band 107, Nr. 42, Okt 2010, S. 733–741. PMID 21079721.
- ↑ L. H. Eberhart, F. Döderlein, G. Eisenhardt, Peter Kranke, D. I. Sessler, A. Torossian, H. Wulf, A. M. Morin: Independent risk factors for postoperative shivering. In: Anesth Analg. Band 101, Nr. 6, Dez 2005, S. 1849–1857. PMID 16301273.
- ↑ P. Alfonsi: Postanaesthetic shivering. Epidemiology, pathophysiology and approaches to prevention and management. In: Minerva Anestesiol. Band 69, Nr. 5, Mai 2003, S. 438–442. Review. PMID 12768180.
- ↑ Peter Kranke, L. H. Eberhart, Norbert Roewer, M. R. Tramèr: Pharmacological treatment of postoperative shivering: a quantitative systematic review of randomized controlled trials. In: Anesth Analg. Band 94. Nr. 2, Feb 2002, S. 453–460. PMID 11812718.
- ↑ a b J. H. Silverstein, M. Timberger, D. L. Reich, S. Uysal: Central nervous system dysfunction after noncardiac surgery and anesthesia in the elderly. In: Anesthesiology. Band 106, Nr. 3, Mar 2007, S. 622–628. Review. PMID 17325520.
- ↑ C.D. Hanning: Postoperative cognitive dysfunction. In: Br J Anaesth. Band 95, Nr. 1, Jul 2005, S. 82–87. Review. PMID 15640305.
- ↑ M. Coburn, A. Fahlenkamp, N. Zoremba, G. Schaelte: Postoperative kognitive Dysfunktion: Inzidenz und Prophylaxe. In: Anaesthesist. Band 59, 2010, S. 177–185. PMID 20084351.
- ↑ G. L. Bryson, A. Wyand: Evidence-based clinical update: general anesthesia and the risk of delirium and postoperative cognitive dysfunction. In: Can J Anaesth. Band 53, Nr. 7, Jul 2006, S. 669–677. Review. PMID 16803914.
- ↑ a b T. N. Robinson, B. Eiseman: PMC 2546478 (freier Volltext) Postoperative delirium in the elderly: diagnosis and management. In: Clin Interv Aging. Band 3, Nr. 2, 2008, S. 351–355. Review. PMID 18686756.
- ↑ C. L. Wu, W. Hsu, J. M. Richman, S. N. Raja: Postoperative cognitive function as an outcome of regional anesthesia and analgesia. In: Reg Anesth Pain Med. Band 29, 2004, S. 257–268. PMID 15138912.
- ↑ a b c Wolf Erhardt: Anästhesie und Analgesie beim Klein- und Heimtier sowie bei Vögeln, Reptilien, Amphibien und Fischen. Schattauer Verlag, 2004, ISBN 3-7945-2057-2.
- ↑ a b Martin Kramer: Kompendium der Allgemeinen Veterinärchirurgie. Schlütersche, 2004, ISBN 3-87706-743-3, S. 144.
- ↑ Michaele Alef, Gerhard Schmidt-Oechtering: Praxis der Inhalationsanästhesie. Enke, 2003, ISBN 3-8304-1015-8.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 12 f.
- ↑ Nicolai Guleke: Kriegschirurgie und Kriegschirurgen im Wandel der Zeiten. Vortrag gehalten am 19. Juni 1944 vor den Studierenden der Medizin an der Universität Jena. Gustav Fischer, Jena 1945, S. 19.
- ↑ Carl Hans Sasse: Geschichte der Augenheilkunde in kurzer Zusammenfassung mit mehreren Abbildung und einer Geschichtstabelle (= Bücherei des Augenarztes. Heft 18). Ferdinand Enke, Stuttgart 1947, S. 27–28.
- ↑ Rudolf Frey, Otto Mayrhofer, mit Unterstützung von Thomas E. Keys, John S. Lundy: Wichtige Daten aus der Geschichte der Anaesthesie. In: R. Frey, Werner Hügin, O. Mayrhofer (Hrsg.): Lehrbuch der Anaesthesiologie und Wiederbelebung. 2., neubearbeitete und erweiterte Auflage. Unter Mitarbeit von H. Benzer. Springer-Verlag, Berlin / Heidelberg / New York 1971, ISBN 3-540-05196-1, S. 13–16, hier: S. 13.
- ↑ Julius Berendes: Die Pharmazie bei den alten Kulturvölkern. Historisch-kritische Studien. Halle an der aale 1891; Neudruck Hildesheim 1965 (und 1989). Zitiert in H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 1.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 1 und 24.
- ↑ L. Brandt (Hrsg.): Illustrierte Geschichte der Anästhesie. 1997, S. 15–28.
- ↑ Nicolai Guleke: Kriegschirurgie und Kriegschirurgen im Wandel der Zeiten. Vortrag gehalten am 19. Juni 1944 vor den Studierenden der Medizin an der Universität Jena. 1945, S. 19.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 13.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 2.
- ↑ Gundolf Keil: Traktat von schlafmachenden Stücken nach der arabischen Weise (Ars somnifera). In: Verfasserlexikon. 2. Auflage. Band 9, Sp. 997 f.
- ↑ Wolfgang Wegner: Traktat von schlafmachenden Stücken nach der arabischen Weise. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1407.
- ↑ Marguerite Louise Baur: Recherches sur l’histoire de l’anesthésie avant 1846. (Dissertation Zürich 1927). Leiden 1927.
- ↑ Theodor Husemann: Die Schlafschwämme und andere Methoden der allgemeinen und örtlichen Anästhesie im Mittelalter. Ein Beitrag zur Geschichte der Chirurgie. In: Deutsche Zeitschrift für Chirurgie. Band 42, 1896, S. 517–596.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 2–4 und 24.
- ↑ Christoph Weißer: Schlafschwamm. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. Walter de Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1299 f.
- ↑ Jürgen Müller: Pharmaca diabolica und Pocula amatoria. Zur Kulturgeschichte der Solanaceen-Alkaloide Atropin und Skopolamin. In: Würzburger medizinhistorische Forschungen. Band 17, 1998, S. 361–373, hier: S. 364 f.
- ↑ Vgl. Karl Sudhoff: Zu den Schlafschwämmen der Borgognoni. In: Archiv für Geschichte der Medizin. Band 13, 1921, S. 127.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 13.
- ↑ E. Darmstaedter: Zur Geschichte der Narkose und Anästhesie. In: Schmerz, Narkose und Anästhesie. Band 4, 1931/1932, S. 117.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 3.
- ↑ Axel W. Bauer: Copho. In: Lexikon des Mittelalters. Band 3, München / Zürich 1995, Sp. 214.
- ↑ Rudolf Creutz: Der Magister Copho und seine Stellung im Hochsalerno. In: Sudhoffs Archiv. Band 33, 1941, S. 249–338.
- ↑ Gundolf Keil: Copho [Kopho]. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 271.
- ↑ Cophonis Ars medendi. In: Salvatore de Renzi, Charles Victor Daremberg, August Wilhelm Henschel (Hrsg.): Collectio Salernitana: ossia documenti inediti, e trattati di medicina appartenenti alla scuola medica Salernitana. 5 Bände, Tipografia del Filiatre-Sebezio, Neapel 1852–1859; Neudruck Bologna 1967 (= Biblioteca di storia della medicina. II, 1–5). Band 4, S. 415–438.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 13.
- ↑ Bernhard Dietrich Haage: Medizinische Literatur des Deutschen Ordens im Mittelalter. In: Würzburger medizinhistorische Mitteilungen. Band 9, 1991, S. 217–231, hier: S. 224 f.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 3.
- ↑ L. Brandt (Hrsg.): Illustrierte Geschichte der Anästhesie. 1997, S. 29–35.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 13.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 13.
- ↑ Richard J. Kitz, Leroy D. Vandam: A History and the Scope of Anesthetic Practice. In: Ronald D. Miller (Hrsg.): Anesthesia. 2. Auflage. Band 1, 1986, S. 4.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 13 f.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 24.
- ↑ Akira Hori: Die erste Vollnarkose: 1804 in Japan. In: Dtsch Arztebl. Band 88, Nr. 47, 1991, S. A-4151. Abgerufen am 14. August 2016.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 14.
- ↑ L. Brandt (Hrsg.): Illustrierte Geschichte der Anästhesie. 1997, S. 49 f.
- ↑ Ken True: The Age of Science: Sir Christopher Wren (1632–1723).
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 15.
- ↑ Richard J. Kitz, Leroy D. Vandam: A History and the Scope of Anesthetic Practice. In: Ronald D. Miller (Hrsg.): Anesthesia. 2. Auflage. Band 1, 1986, S. 4 und 11.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 14.
- ↑ Otto Mayrhofer: Gedanken zum 150. Geburtstag der Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 881–883, hier: S. 881.
- ↑ Richard J. Kitz, Leroy D. Vandam: A History and the Scope of Anesthetic Practice. In: Ronald D. Miller (Hrsg.): Anesthesia. 2. Auflage. Band 1, 1986, S. 3–25, hier: S. 6–8.
- ↑ Christoph Weißer: Anästhesie. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin 2005, ISBN 3-11-015714-4, S. 54 f., hier: S. 54.
- ↑ Ludwig Brandt, Karl-Heinz Krauskopf: „Eine Entdeckung in der Chirurgie“. 150 Jahre Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 970–975, hier: S. 973.
- ↑ R. P. Haridas: Photographs of Early Ether Anesthesia in Boston: The Daguerreotypes of Albert Southworth and Josiah Hawes. In: Anesthesiology. Band 113, Nr. 1, Juli 2010, S. 13–26. PMID 20526183.
- ↑ Ken True: Pioneer: Dr William E Clarke.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 14.
- ↑ Richard J. Kitz, Leroy D. Vandam: A History and the Scope of Anesthetic Practice. In: Ronald D. Miller (Hrsg.): Anesthesia. 2. Auflage. Band 1, 1986, S, 6.
- ↑ a b c L. Brandt (Hrsg.): Illustrierte Geschichte der Anästhesie. 1997, S. 52–65.
- ↑ a b L. Brandt, K.-H. Krauskopf: 150 Jahre Anästhesie: „Eine Entdeckung in der Chirurgie.“. In: Dtsch Arztebl. 93(45), 1996, S. A-2957 / B-2293 / C-2089.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 14.
- ↑ Robert Hirst: From Out of the Primordial Soup: A Brief History of Anaesthesia. In: The Internet Journal of Anesthesiology. Volume 10, Number 1, 2005.
- ↑ L. Brandt (Hrsg.): Illustrierte Geschichte der Anästhesie. 1997, S. 67–77 (Zitate S. 67)
- ↑ Vgl. H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 12.
- ↑ L. Brandt (Hrsg.): Illustrierte Geschichte der Anästhesie. 1997, S. 78–96.
- ↑ Vgl. etwa Ernst Gurlt: Zur Narkotisierungsstatistik. In: Verhandlungen des deutschen Chirurgenkongresses. 6. Bericht, 1897.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 13 f.
- ↑ Betty J. Bamforth: Cyclopropane Anesthesia: Its Introduction at Wisconson. In: J. Ruprecht, M. J. van Lieburg, J. A. Lee, W. Erdmann (Hrsg.): Anaesthesia. Essays on Its History. Springer, Berlin / Heidelberg 1985, ISBN 3-540-13255-4, Kapitel 4.19.
- ↑ Rudolf Frey, Werner Hügin, Otto Mayrhofer (Hrsg.): Lehrbuch der Anaesthesiologie. Springer, Berlin / Göttingen / Heidelberg 1955; Nachdruck Berlin / Heidelberg, ISBN 978-3-662-01557-5, S. 344–346 (Cyclopropan)
- ↑ Cyclopropane anesthesia. In: Journal of the American Medical Association. Band 103, Nr. 13, S. 975–983.
- ↑ G. Döderlein: Rundtischgespräch: Die Möglichkeiten, der gebärenden Frau Angst und Schmerzen zu nehmen. In: H. Runge, H. Naujoks (Hrsg.): Verhandlungen der deutschen Gesellschaft für Gynäkologie. Einunddreißigste Versammlung abgehalten zu Heidelberg vom 18. bis 22. September 1956. (= Archiv für Gynäkologie. Band 189): Wissenschaftlicher Teil. Springer, Berlin / Heidelberg 1957, ISBN 978-3-642-53808-7, S. 311–335, hier: S. 327.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 14 f.
- ↑ Thomas Beddoes, James Watt: Considerations on the Medicinal Use, and on the Production of Factitious Aires. J. Johnson, Bristol 1795.
- ↑ Thomas E. Keys: Die Geschichte der chirurgischen Anaesthesie. Springer, Berlin / Heidelberg 1968, ISBN 978-3-540-04040-8, S. 34 f.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 14.
- ↑ Tierversuche mit einer Beatmung über endotracheale Intubation machte 1542 bereits Andreas Vesalius. Vgl. Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 13.
- ↑ Friedrich Wilhelm Gierhake, Julius Muasya Kyambi: Lunge und Pleurahöhle. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Mit einem Geleitwort von Rudolf Nissen. Dustri-Verlag Dr. Karl Feistle, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 153–163, hier: S. 157.
- ↑ Vgl. auch H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 21.
- ↑ Vgl. Friedrich Wilhelm Gierhake, Julius Muasya Kyambi: Lunge und Pleurahöhle. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Mit einem Geleitwort von Rudolf Nissen. Dustri-Verlag Dr. Karl Feistle, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 153–163, hier: S. 156 f.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 14.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 21 und 23.
- ↑ Otto Mayrhofer: Gedanken zum 150. Geburtstag der Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 881–883, hier: S. 882.
- ↑ Elisabeth Bredenfeld: Die intravenöse Narkose mit Arzneigemischen. In: Zeitschrift für experimentelle Pathologie und Therapie. Band 18, 1916, S. 80 ff.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 16.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 14.
- ↑ Ulf Glade: Geschichte der Anästhesie. ulfglade.wordpress.com
- ↑ www.researchgate.net: Arno B. Luckhardt.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 15.
- ↑ Vgl. auch R. Bumm: Intravenöse Narkosen mit Barbitursäurederivaten. In: Klinische Wochenschrift. Band 6, 1927, S. 725 ff.
- ↑ Vgl. auch John S. Lundy: Intravenous anaesthesia: preliminary report of the use of two barbiturates. In: Proc. Mayo Clin. Band 10, 1935, S. 536 ff.
- ↑ Ludwig Burkhardt: Die intravenöse Narkose mit Äther und Chloroform. In: Münchner medizinische Wochenschrift. Band 2, 1909, S. 2365 ff.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 14 f.
- ↑ Vgl. auch Ludwig Burkhardt: Über intravenöse Narkose. In: Münchner medizinische Wochenschrift. Band 15, 1911, S. 778 ff.
- ↑ Vgl. N. P. Krakow: Über die Hedonal-Chloroformnarkose. In: Archiv für experimentelle Pathologie und Pharmakologie. Supplement 317, 1908.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 15.
- ↑ Stellungnahme des Ausschusses „Anästhesie und Analgesie“ der GV-SOLAS zum Einsatz von Tribromethanol (TBE, Avertin, E107, Renarcol, Byk 250) bei Labortieren. Geschichtlicher Hintergrund und Einsatzgebiet. (PDF) gv-solas.de
- ↑ Richard Bumm: Intravenöse Narkosen mit Barbitursäurederivaten. In: Ergebnisse der Chirurgie und Orthopädie. Band 29, 1936, S. 372–414, hier: S. 374.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 16.
- ↑ Alan Dronsfield, Pete Ellis, John Prin: From Waterloo to Thiopentone. The Early Chemical History of Intravenous Anaesthesia. In: RSC Historical Group Newsletter. Nr. 67, Winter 2015, S. 10–12.
- ↑ H. Noel, H. S. Soutarr: The anaesthetic effects of intravenous injections of paraldehyde. In: Annales of Surgery. Band 57, 1913, S. 64 ff.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 15 f.
- ↑ Michael Heck, Michael Fresenius: Repetitorium Anaesthesiologie. Vorbereitung auf die anästhesiologische Facharztprüfung und das Europäische Diplom für Anästhesiologie. 3., vollständig überarbeitete Auflage. Springer, Berlin / Heidelberg / New York u. a. 2001, ISBN 3-540-67331-8, S. 804.
- ↑ Otto Mayrhofer: Gedanken zum 150. Geburtstag der Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 881–883, hier: S. 883.
- ↑ Jackson CO2 Absorber. The Wood Library Museum.
- ↑ Ulf Gade: Geschichte der Anästhesie. ulfglade.wordpress.com
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 15.
- ↑ Josef Haupt: Die Geschichte der Dräger-Narkoseapparate. Band I. 1. überarbeitete Version. hrsg. von der Drägerwerk AG. Rosenbauer und Solbach, Hamburg 1996, ISBN 3-926762-14-4, S. 31 f. und 51.
- ↑ Hans Killian: Hinter uns steht nur der Herrgott. Sub umbra dei. Ein Chirurg erinnert sich. Kindler, München 1957; hier: Lizenzausgabe als Herder-Taschenbuch (= Herderbücherei. Band 279). Herder, Freiburg / Basel / Wien 1975, ISBN 3-451-01779-2, S. 87 f.
- ↑ Gail McLachlan: Sir Ivan Magill KCVO, DSc, MB, BCh, BAO, FRCS, FFARCS (Hon), FFARCSI (Hon), DA, (1888–1986). In: Ulster Medical Journal. Band 77, Nr. 3, 2008, S. 146–152, PMC 2604469 (freier Volltext)
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, hier zitiert, S. 15.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 26.
- ↑ Franz Kuhn: Die Perorale Intubation. Ein Leitfaden zur Erlernung und Ausführung der Methode mit reicher Kasuistik. Mit einem Vorwort von Geh. Rat Prof. Dr. O. Hildebrand. Karger, Berlin 1911; Neudruck Karger, Basel, ISBN 978-3-318-02903-1.
- ↑ L. Brandt (Hrsg.): Illustrierte Geschichte der Anästhesie. 1997, S. 163–169.
- ↑ Harold R. Griffith, G. Enid Johnson: The use of curare in general anaesthesia. In: Anesthesiology. Band 3, 1942, S. 418–420.
- ↑ Michael Heck, Michael Fresenius: Repetitorium Anaesthesiologie. Vorbereitung auf die anästhesiologische Facharztprüfung und das Europäische Diplom für Anästhesiologie. 3., vollständig überarbeitete Auflage. Springer, Berlin / Heidelberg / New York u. a. 2001, ISBN 3-540-67331-8, S. 803.
- ↑ Erich Kirchner: Vorbemerkung. In: Wolfgang Seitz (Hrsg.): Klinik der Muskelrelaxation. 50 Jahre nach Griffith und Johnson. 1994, S. 1.
- ↑ Vgl. auch H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 26 (dort wird 1949 genannt).
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 15.
- ↑ S. J. Basta: Clinical pharmacology of mivacurium chloride: a review. In: Journal of Clinical Anesth. Band 4, Nr. 2, März–April 1992, S. 153–163.
- ↑ Michael Heck, Michael Fresenius: Repetitorium Anaesthesiologie. Vorbereitung auf die anästhesiologische Facharztprüfung und das Europäische Diplom für Anästhesiologie. 3., vollständig überarbeitete Auflage. Springer, Berlin / Heidelberg / New York u. a. 2001, ISBN 3-540-67331-8, S. 804.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 26.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 15.
- ↑ Michael Heck, Michael Fresenius: Repetitorium Anaesthesiologie. Vorbereitung auf die anästhesiologische Facharztprüfung und das Europäische Diplom für Anästhesiologie. 2001, S. 804.
- ↑ Rudolf Frey, Otto Mayrhofer: Wichtige Daten aus der Geschichte der Anaesthesie. 1971, S. 15.
- ↑ Ernst Kern: Sehen – Denken – Handeln eines Chirurgen im 20. Jahrhundert. ecomed, Landsberg am Lech 2000, ISBN 3-609-20149-5, S. 280.