Dihydropyran
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dihydropyran | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H8O | |||||||||||||||
| Kurzbeschreibung |
gelbe, übelriechende Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 84,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,927 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
89 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,440[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Dihydropyran (nach IUPAC-Nomenklatur: 3,4-Dihydro-2H-pyran, abgekürzt als DHP bezeichnet) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Sauerstoffheterocyclen bzw. Enolether.
Gewinnung und Darstellung
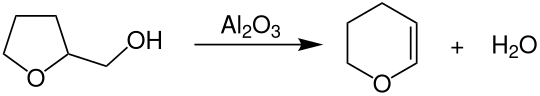
Die technische Herstellung von Dihydropyran erfolgt durch die Dehydratisierung von Tetrahydrofurfurylalkohol bei Temperaturen von 300–350 °C unter Normaldruck über einem heterogenen Aluminiumoxid-Katalysator in Rohrreaktoren.[5]
Bei dieser Reaktion handelt es sich genauer um eine Dehydratisierung mit anschließender Ringerweiterung.[6]
Eigenschaften
Physikalische Eigenschaften
Chemisch gesehen ist es ein Enolether, das heißt, dass der Ethersauerstoff unmittelbar an eine Kohlenstoff-Kohlenstoff-Doppelbindung gebunden ist. Enolether sind aufgrund der +M-Effekts des Sauerstoffs elektronenreiche, ungesättigte Verbindungen, die leicht mit Elektrophilen, zum Beispiel Protonen (H+), reagieren können.
Chemische Eigenschaften
Bei organischen Synthesen wird die 2-Tetrahydropyranylgruppe als Schutzgruppe für Alkohole und Thiole benutzt. Die Reaktion eines Alkohols mit Dihydropyran führt zur Bildung eines basenstabilen Tetrahydropyranylethers bzw. eines cyclischen Acetals, wodurch der Alkohol vor einer Vielzahl von unerwünschten Nebenreaktionen geschützt ist. Der Alkohol kann anschließend leicht durch saure Hydrolyse wieder freigesetzt werden. Als Nebenprodukt entsteht 5-Hydroxypentanal.
Sicherheitstechnische Kenngrößen
Die Verbindung bildet leicht entzündliche Dampf-Luft-Gemische. Der Flammpunkt beträgt −9 °C.[1] Der Explosionsbereich liegt zwischen 1,1 Vol.‑% als untere Explosionsgrenze (UEG) und 13,8 Vol.‑% als obere Explosionsgrenze (OEG).[1] Die Zündtemperatur beträgt 240 °C[7] Der Stoff fällt somit in die Temperaturklasse T3.
Verwendung
Dihydropyran ist ein Zwischenprodukt für die Herstellung von Pflanzenschutzmitteln und Pharmazeutika.[1] Es dient weiterhin der Bildung einer Schutzgruppe für verschiedene funktionelle Gruppen (z. B. Alkohole, Thiole, Amine und Amide) bei organischen Synthesen.[6]
Sicherheitshinweise
Dihydropyran ist leichtentzündlich, leicht flüchtig und bildet mit Luft bei Lichteinwirkung explosive Peroxide.
Siehe auch
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i j k l m Eintrag zu 3,4-Dihydro-2H-pyran in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Informationen von UBE Chemical (Memento vom 5. Februar 2007 im Internet Archive) (englisch).
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Datenblatt 3,4-Dihydro-2H-pyran bei Merck, abgerufen am 23. April 2019.
- ↑ Niklaus Künzle: A process for preparing dihydropyran and its use as protective agent. In: Google Patents. Lonza Ltd., 7. April 2011, abgerufen am 23. April 2019.
- ↑ a b Eintrag zu 3,4-Dihydro-2H-pyran. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. April 2019.
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.