Lithium-Ionen-Akkumulator
Ein Lithium-Ionen-Akkumulator ([ˈliːtʰiʊm]-) oder Lithium-Akkumulator (auch Lithiumionenakku, Lithiumionen-Akku, Lithiumionen-Sekundärbatterie) ist ein Akkumulator auf der Basis von Lithium-Verbindungen in allen drei Phasen der elektrochemischen Zelle. Die reaktiven Materialien – der negativen und der positiven Elektrode und des Elektrolyten – enthalten Lithiumionen.
Lithium-Ionen-Akkumulatoren haben eine höhere spezifische Energie (Energie pro Eigenmasse) als andere Akkumulatortypen. Sie reagieren auf Tiefentladung und auf Überladung nachteilig und brauchen deshalb elektronische Schutzschaltungen.
Allgemeines
Datei:Wie funktioniert eine Lithium-Ionen-Batterie?.webm Es gibt zahlreiche verschiedene Lithium-Ionen-Akkumulatoren. Sie unterscheiden sich nicht nur in der Größe und Bauform, sondern auch in der chemischen Zusammensetzung ihrer Komponenten und haben auch verschiedene Spannungsbereiche. Für etwa zwei Jahrzehnte waren die meisten der auf den Markt gebrachten lithiumbasierten Akkumulatoren Lithium-Cobaltdioxid-Akkumulatoren. Heute werden vor allem die auf Lithium-Nickel-Mangan-Cobalt-Oxiden basierenden NMC-Akkumulatoren verkauft.[1] Die Kenndaten wie Zellenspannung, Temperaturempfindlichkeit, Lade- und Entladeschlussspannung und der maximal erlaubte Lade- oder Entladestrom variieren bauartbedingt und sind wesentlich vom eingesetzten Elektrodenmaterial und Elektrolyten abhängig. Die Angabe des genauen Typs, beispielsweise Lithium-Eisenphosphat-Akkumulator, ist aus diesem Grund informativer als die unspezifische Angabe des Oberbegriffs Lithium-Ionen-Akkumulator. Zusätzlich zu den Varianten aufgrund der Elektrodenmaterialien gibt es Varianten aufgrund verschiedener Elektrolyte: die Zelle kann einen flüssigen Elektrolyten enthalten oder als Lithium-Polymer-Akkumulator ausgeführt sein.[2]
Allen Lithium-Ionen-Akkumulatoren gemeinsam ist, dass die Zellen gasdicht versiegelt sein müssen und lageunabhängig betrieben werden können. Die spezifische Energie liegt in der Größenordnung von 150 Wh/kg und die Energiedichte in der Größenordnung von 400 Wh/l, womit Lithium-Ionen-Akkumulatoren insbesondere im Bereich mobiler Anwendungen als elektrischer Energiespeicher interessant sind und den Aufbau kleiner und leichter Akkumulatoren erlauben.[3] Die temperaturabhängige Selbstentladungsrate liegt im Bereich von nahe 0 % bis 8 % pro Monat, der typische Temperaturbereich für den Einsatz liegt bei ca. −30 °C bis +60 °C.
Ein weiteres Merkmal aller Lithium-Ionen-Akkumulatoren ist, dass die Zellen von der Zellchemie her nicht imstande sind, Überladungen zu verkraften.[4] Bei einem Verbund mehrerer Zellen in Reihe zum Erzielen einer höheren elektrischen Spannung müssen zum Ausgleich der Toleranzen in der Kapazität zwischen den Zellen meistens zusätzliche Maßnahmen in Form eines Batteriemanagementsystems (BMS) und Balancers vorgesehen werden.
Die meisten Lithium-Ionen-Akkumulatorentypen werden durch Übertemperatur beschädigt, da es bei einigen der häufig eingesetzten Oxide wie Lithium-Cobalt(III)-oxid und Mischoxiden wie Lithium-Nickel-Mangan-Cobalt-Oxiden ab Temperaturen von ca. 180 °C zu einem thermischen Durchgehen kommt. Oxide wie Nickeldioxid, welche zwar den Bau von Lithium-Ionen-Akkumulatoren mit vergleichsweise hoher spezifischer Kapazität erlauben, neigen stark zu thermischem Durchgehen und werden daher in kommerziellen Anwendungen praktisch nicht verwendet.[5] Beim thermischen Durchgehen wird durch den chemischen Zerfall des Oxids im Akkumulator Sauerstoff freigesetzt, welcher chemisch mit Zellbestandteilen wie dem Elektrolyten reagiert und so zu einer sich selbst steigernden, von außen nicht mehr anhaltbaren exothermen Reaktion und thermischer Zerstörung des Akkumulators führt. Dies gilt für alle bekannten Kathodenmaterialien, auch für Lithiumeisenphosphat.[6] Die Kathodenmaterialien unterscheiden sich allerdings in der Onset-Temperatur (bei der die exotherme Reaktion beginnt) und hinsichtlich der dabei freigesetzten Energie.
Im Gegensatz zu den nicht wiederaufladbaren Lithiumbatterien und der Gruppe von Lithiumakkumulatoren, die metallisches Lithium im Aufbau nutzen, tritt in Lithium-Ionen-Akkumulatoren kein metallisches Lithium auf – das Lithium wird bei allen heutigen Lithium-Ionen-Akkumulatortypen im Wirtsgitter eines Trägermaterials gebunden.[7] Wenn sich das Wirtsgitter dabei kaum verändert, spricht man von Interkalation. Je nach Typ werden im Rahmen der Herstellung von Akkus mit einer Speicherfähigkeit der Energiemenge von einer Kilowattstunde etwa 80 g bis 130 g chemisch reines Lithium benötigt. Lithium-Ionen, auch die in Akkumulatoren, sind monovalent (Li+), was – verglichen mit multivalenten Ionen wie Mg2+ oder Al3+ – einen wesentlich besseren Transport in Festkörpern erlaubt[8] und damit die Nutzung von Interkalationsprozessen möglich macht.
Mit den Lithium-Ionen-Akkumulatoren im Aufbau und Verfahren verwandt sind die Natrium-Ionen-Akkumulatoren, welche das Alkalimetall Natrium in Form von Na+-Ionen verwenden und eine ähnliche Typenvariation aufweisen, aber physikalisch bedingt grundsätzlich eine geringere Energiedichte haben.[9] Dank jüngerer Forschungsarbeiten ist der Wandel vom theoretischen Konzept zur praxistauglichen Technologie inzwischen gelungen. Ein koreanischer Prototyp schafft etwa 500 Ladezyklen, bevor die Kapazität auf 80 Prozent fällt. Im Vergleich zur Lithium-Akkutechnik wird die Herstellung von Natrium-Ionen-Akkus nicht durch knappe Ressourcen begrenzt.[10]
Geschichte
Bereits in den 1970er Jahren wurden an der TU München das grundlegende Funktionsprinzip der reversiblen Alkalimetallionen-Interkalation in Kohlenstoff-Elektroden[11][12] sowie oxidische Elektroden[13][14] und deren Anwendung in Lithium-Batterien[15][16] erforscht und veröffentlicht (Jürgen Otto Besenhard und andere), auch wenn damals die praktische Anwendbarkeit als Elektroden für Lithium-Batterien nicht erkannt wurde. In den 1970er Jahren fand Stanley Whittingham ein vielversprechendes Kathodenmaterial für Lithiumbatterien in Form von Titandisulfid, das in seinen atomaren Zwischenräumen Lithiumionen aufnehmen kann.[17] Mit einer Anode aus metallischem Lithium liefert eine Titandisulfid-Zelle eine Spannung von etwa 2 Volt. In der Zeit von 1977 bis 1979 wurden kleine Titandisulfid-Zellen mit einer Lithiumlegierung statt mit Lithium für Uhren verkauft.[18]
In den späten 1970er Jahren schlug Michel Armand ein Akkumulatorkonzept vor, bei dem sowohl an der Pluspolseite als auch an der Minuspolseite strukturstabile feste Materialien verwendet werden, die Lithium aufnehmen und wieder abgeben können, d. h. Interkalationsmaterialien.[19] Beim Laden und Entladen pendeln Lithiumionen zwischen den Elektroden hin und her; das Konzept wurde wegen der Hin- und Herbewegung „Schaukelstuhlakku“ (rocking chair battery) genannt.[19] Bruno Scrosati baute die ersten entsprechenden Zellen und vermaß den Spannungsverlauf beim 70maligen Laden und Entladen.[19][20] Damit war das Prinzip des Lithium-Ionen-Akkumulators gefunden, es fehlten aber noch die für eine Kommerzialisierung nötigen kostengünstigen, möglichst leichten Materialien mit hoher Spannung.
Die Brauchbarkeit von Lithium-Cobalt(III)-oxid als Elektrodenmaterial für die Pluspolseite (bei der Entladung Kathode) wurde 1980 von einer Forschergruppe um John B. Goodenough beschrieben, der an der University of Oxford arbeitete.[21] Goodenough fand das Material nach systematischer Suche, ausgehend davon, dass er ein Metalloxid mit eingelagerten Lithiumionen für vielversprechender hielt als das Metallsulfid von Whittingham.[17] Er erreichte Zellspannungen von 4 Volt. Die erfolgreiche industrielle Umsetzung gelang zuerst 1985 in Japan durch Akira Yoshino, Chemiker bei Asahi Kasei. Er baute auf dem Kathodenkonzept von Goodenough auf und verwendete für die Anode statt des reaktiven metallischen Lithiums Petrolkoks, der Lithiumionen aufnehmen kann. Ein Vorteil neben dem relativ geringen Gewicht von Graphit ist seine hohe Haltbarkeit, da er als Interkalationsmaterial Lithiumionen aufnimmt, ohne dass das Elektrodenmaterial durch die chemische Reaktion mit dem Lithium „aufgebrochen“ wird.[17]
Der erste kommerziell erhältliche Lithium-Ionen-Akku war damit der Lithium-Cobaltdioxid-Akkumulator, auch LiCoO2-Akku, der von Sony im Jahr 1991 auf den Markt gebracht und in der Hi8-Videokamera CCD TR 1 eingesetzt wurde. Die Batterie aus zwei seriell verschalteten Zellen hatte eine Spannung von 7,2 V und eine Kapazität von etwa 1200 mAh. Bis heute (2016) werden Akkumulatoren dieser Bauform mit Kapazitäten bis 6900 mAh angeboten und in einer Vielzahl von Geräten eingesetzt.[22]
Whittingham, Goodenough und Yoshino erhielten 2019 für die Entwicklung der Lithium-Ionen-Batterie den Nobelpreis für Chemie.
Im Jahr 2020 fanden Forscher der Columbia University heraus, dass die Zugabe von Kalium Lithium-Metall-Akkumulatoren (nicht: Lithium-Ionen-Akkumulatoren) langlebiger und sicherer macht. So verhindere das Kalium unerwünschte chemische Nebenreaktionen.[23][24]
Anwendung
Lithium-Ionen-Akkus versorgten anfangs hauptsächlich tragbare Geräte mit hohem Energiebedarf, für die herkömmliche Nickel-Cadmium- oder Nickel-Metallhydrid-Akkus zu schwer oder zu groß waren, beispielsweise Mobiltelefone, Tablets, Digitalkameras, Camcorder, Notebooks, Handheld-Konsolen, Softairwaffen oder Taschenlampen. Mittlerweile sind sie in fast allen Bereichen anzutreffen. Sie dienen bei der Elektromobilität als Energiespeicher für Pedelecs, Elektroautos, moderne Elektrorollstühle und Hybridfahrzeuge. Das Fraunhofer-Institut für System- und Innovationsforschung ISI erwartete 2020, dass die Nachfrage nach Lithium-Ionen-Zellen allein für die Elektromobilität bis 2030 um den Faktor 20 bis 40 steigen wird.[25]
Auch im RC-Modellbau haben sie sich früh etabliert. Durch ihr geringes Gewicht sind sie, in Verbindung mit bürstenlosen Gleichstrommotoren und den entsprechenden Reglern, gut als Antriebseinheit im Flugmodellbau geeignet. Seit 2003 gibt es Lithium-Ionen-Akkus in Elektrowerkzeugen wie zum Beispiel Akkuschraubern und in Gartengeräten. In der Boeing 787 werden Lithium-Kobaltoxid-Akkus (LiCoO2) verwendet. Sie erhielten nach mehreren Bränden nachträglich eine Stahlummantelung. Andere Flugzeuge sind (2012) mit Lithium-Eisenphosphat-Akkus ausgerüstet.[26] Lithium-Ionen-Batterie-Systeme werden auch in Batterie-Speicherkraftwerken und Solarbatterien eingesetzt (siehe auch Auflistung solcher Batteriespeicher).
Prinzip
Im geladenen Lithium-Ionen-Akkumulator wird die elektrische Potentialdifferenz der Elektroden in einem elektrochemischen Prozess mit Stoffänderung der Elektroden zur Stromerzeugung genutzt. Im Akkumulator können Lithiumionen (Li+) frei durch den Elektrolyten zwischen den beiden Elektroden wandern, wovon sich der Name des Akkus ableitet. Im Gegensatz zu den Lithiumionen sind die Übergangsmetall- und Graphit-Strukturen der Elektroden ortsfest und durch einen Separator vor einem direkten Kontakt geschützt. Die Mobilität der Lithiumionen ist zum Ausgleich des externen Stromflusses beim Laden und Entladen nötig, damit die Elektroden selbst (weitgehend) elektrisch neutral bleiben.
Die negative Elektrode ist eine Graphit-Intercalationsverbindung mit der allgemeinen Zusammensetzung LixCn, wobei Lithium als Kation vorliegt. Beim Entladen gibt die Interkalationsverbindung Elektronen ab, die über den externen Stromkreis zur positiven Elektrode fließen. Gleichzeitig wandern gleich viele Li+-Ionen aus der Intercalationsverbindung durch den Elektrolyten ebenfalls zur positiven Elektrode. An der positiven Elektrode nehmen nicht die Lithiumionen die Elektronen des externen Stromkreises auf, sondern die dort vorhandenen Strukturen der Übergangsmetallverbindungen. Je nach Akkumulatortyp können das Cobalt-, Nickel-, Mangan- oder Eisen-Ionen sein, die ihre Ladung ändern. Das Lithium liegt im entladenen Zustand des Akkumulators in der positiven Elektrode weiterhin in Ionenform vor.
Da die Affinität der Lithiumionen zum Material der positiven Elektrode größer ist als ihre Affinität zur negativen (Graphit-)Elektrode, wird beim Fließen von Lithiumionen von der negativen zur positiven Elektrode Energie freigesetzt.
Innerhalb beider Elektroden können sich Elektronen als Elektronengas frei bewegen und zu den externen Leitern wandern bzw. aus den Leitern in die Elektrode eintreten, nicht jedoch zwischen den Elektroden innerhalb des Akkumulators wandern. Die Trennwand (Separator) ist elektronenundurchlässig, was einen Kurzschluss verhindert.
Aufbau
An Materialien werden unter anderem verwendet:
Negative Elektrode (beim Entladen: Anode; beim Laden: Kathode)
- Graphit und verwandte Kohlenstoffe, bei denen eine Interkalation von Lithium stattfindet, sind immer noch die wichtigsten Materialien,
- nanokristallines, amorphes Silicium (Legierungsbildung mit Lithium),
- Lithiumtitanate wie Li4Ti5O12 (Anwendung bei Lithiumtitanat-Akkumulatoren),
- Zinndioxid (SnO2).
Elektrolyt
- Salze wie Lithiumhexafluorophosphat (LiPF6), Lithiumtetrafluorborat (LiBF4) oder Lithiumbis(oxalato)borat (LiBOB) gelöst in wasserfreien aprotischen Lösungsmitteln wie z. B. Ethylencarbonat, Propylencarbonat, Dimethylcarbonat, Diethylcarbonat oder 1,2-Dimethoxyethan,[27]
- Polymere aus Polyvinylidenfluorid (PVDF) oder Polyvinylidenfluorid-Hexafluorpropen (PVDF-HFP) im Lithium-Polymer-Akkumulator,
- Lithiumphosphatnitrid (Li3PO4N),
- Lithiumtitanthiophosphat (LiTi2(PS4)3),
- LISICON (Li2+2xZn1−xGeO4).
Positive Elektrode (beim Entladen: Kathode; beim Laden: Anode)
- Lithium-Cobalt(III)-oxid (LiCoO2, „LCO“) und verwandte Schichtverbindungen. Im Jahr 2008 wurde in etwa 90 % aller verkauften Lithium-Ionen-Akkumulatoren LiCoO2 eingesetzt,[28]
- Lithium-Nickel-Mangan-Cobalt-Oxide wie z. B. LiNi0,33Co0,33Mn0,33O2, die Mischoxide aus dem genannten LiCoO2, aus LiNiO2 und LiMnO2 sind. Eine manganfreie Variante ist das Oxid LiNi1−xCoxO2,
- Lithium-Nickel-Cobalt-Aluminium-Oxid („NCA“, LiNi1−x−yCoxAlyO2) z. B. LiNi0,85Co0,1Al0,05O2,
- Spinelle wie das Lithiummanganoxid LiMn2O4 („LMO“),
- Lithiumeisenphosphat (LiFePO4, „LFP“) im Lithium-Eisenphosphat-Akkumulator.
Separator
- Polyolefin-Membran ohne und mit nanokeramischer Schicht,
- High purity alumina (HPA) Separator.[29]
Stromableiter
- Kupferfolie an der Minuspolseite. Hier verwendet man nicht Aluminium, weil Aluminium an der negativen Elektrode mit Lithium reagieren würde,
- Aluminiumfolie an der Pluspolseite. Hier verwendet man das kostengünstige und leichte Material, das in geeigneten Elektrolyten durch Passivierung vor Korrosion geschützt ist.
Reaktionsgleichungen
Im Folgenden sind beispielhaft die für den Lithium-Mangan-Akkumulator geltenden chemischen Reaktionsgleichungen bei Entladung und Ladung angeführt.
Negative Elektrode (Entladen):
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{Li}_x\mathrm{C}_n \rightarrow\ \,\mathrm{C}_n + x\,\mathrm{Li}^+ + x\,\mathrm{e}^- }
Positive Elektrode (Entladen):
Redox-Gleichung:
Bauformen
Handelsübliche Einzelzellen von Lithium-Ionen-Akkumulatoren werden üblicherweise in zylindrischer Bauform, als mit speziellem Gehäuse konfektionierte Einzelzellen (prismatische Zelle) oder als Pouch-Zellen ausgeführt. Die zylindrische Bauform ist dabei mit einer fünfstelligen Zahl gekennzeichnet und ermöglicht so einen einfachen Austausch. Die ersten beiden Ziffern geben den Zelldurchmesser in Millimeter an, die dritte und vierte Stelle die Länge der Zelle in Millimeter. In nachfolgender Tabelle sind beispielhaft einige übliche Zellgrößen mit den typischen Kapazitätswerten angegeben. Die konkreten Werte zu der Kapazität stellen grobe Richtwerte dar und sind vom konkreten Zelltyp und Hersteller abhängig.
| Zellbe- zeichnung |
Typische Kapazität (in Ah) |
Abmessungen (ø × l in mm) |
Hinweis |
|---|---|---|---|
| 10180 | 0,3–0,4 | 10 × 18 | Bauform wie 2⁄5 AAA-Zelle |
| 10280 | 0,3–0,4 | 10 × 28 | Bauform wie 2⁄3 AAA-Zelle |
| 10440 | 0,3–0,4 | 10 × 44 | Bauform wie AAA-Zelle |
| 13450 | 0,5–0,7 | 13 × 45 | Einsatz bei E-Zigaretten |
| 14250 | 0,25–0,3 | 14 × 25 | Bauform wie 1⁄2 AA-Zelle |
| 14430 | 0,6–0,7 | 14 × 43 | Bauform wie 4⁄5 AA-Zelle |
| 14500 | 0,7–0,8 | 14 × 53 | Bauform wie AA-Zelle |
| 14650 | 0,9–1,6 | 14 × 65 | |
| 16340 | 0,6–1,0 | 16 × 34 | |
| 16500 | 0,8–1,2 | 16 × 50 | |
| 16650 | 2–3 | 16 × 65 | Schmale Bauform der 18650 |
| 17500 | 0,7–1,2 | 17,3 × 50 | Bauform wie A-Zelle |
| 17650 | 1,2–2,5 | 17 × 65 | |
| 18350 | 0,7–1,2 | 18 × 35 | |
| 18500 | 1,1–2,2 | 18,3 × 49,8 | |
| 18650 | 0,8–3,5 | 18,6 × 65,2 | Weitverbreitete Bauform, u. a. in Notebooks, Elektroautos, E-Zigaretten und Taschenlampen |
| 21700 | 3–5[30] | 21 × 70 | auch als 2170 bezeichnet, Anwendung bislang überwiegend in Elektroautos und E-bikes[31][32] |
| 22500 | 2,0–2,6 | 22,3 × 51,4 | Ersatz für 3×AAA-Pack in Taschenlampen |
| 23430 | 3,3–5,2 | 23 × 43 | Wie Sub-C-Zelle |
| 25500 | 3,7–5 | 24,3 × 49,2 | |
| 26500 | 2–4 | 26 × 50 | Bauform wie C-Zelle |
| 26650 | 3,3–5,2 | 26,5 × 65,4 | Weitverbreitete Bauform, u. a. in Elektroautos |
| 32600 | 5,5–6 | 32 × 61,9 | Bauform wie D-Zelle |
| 4680 | k.a. | 46 × 80 | Tesla, in zukünftigen Elektroautos[33] |
Eigenschaften
Da Lithium-Ionen-Akkumulator der Oberbegriff für eine Vielzahl an möglichen Kombinationen von Materialien für Anode, Kathode und Separator darstellt, ist es schwierig, allgemeingültige Aussagen zu treffen. Je nach Materialkombination unterscheiden sich die Eigenschaften teilweise deutlich. Hinzu kommt die fortwährende Verbesserung durch die Batteriehersteller, die in den letzten Jahren insbesondere auf den bekannten Problemfeldern wie Haltbarkeit und Sicherheit erhebliche Verbesserungen erzielen konnten, während die spezifische Energie nur in vergleichsweise geringem Umfang erhöht wurde.[34]
Dendritenbildung
Bei dieser Art der Akkumulatoren durch Verwendung von Lithiumfolien statt Lithiumgitter kann es zu Fehlern wie Dendritenbildung kommen. Hierbei lagert sich Lithium, welches beim Entladen des Akkumulators in Lösung ging, beim erneuten Ladevorgang nicht wieder an derselben Stelle ab und bildet somit Dendrite. Diese durchsetzen den Separator, können diesen später auch durchdringen und somit Kurzschlüsse verursachen. "Selbst die schützende Deckschicht, die sich bei geeigneten Elektrolyten um das Lithiummetall herum bildet, würde bei Kurzschluss und den dort auftretenden hohen Temperaturen (über 180,5 °C und somit über dem Schmelzpunkt von Lithium) nicht standhalten können und zerstört werden. Dabei entsteht bei den häufig auftretenden brennbaren und organischen Elektrolyten ein entzündliches Gemisch. Diese Gefahr wird durch meist zu hohe Ströme oder Ladefehler verursacht."[35]
Lebensdauer
Lithium-Ionen-Akkus verschlechtern sich sowohl durch Benutzung, wobei eine vollständige Ladung und Entladung als Zyklus bezeichnet wird, als auch ohne Benutzung einfach mit der Zeit (kalendarische Lebensdauer). Insbesondere die Mehrheit der in Endverbrauchergeräten verbauten Lithium-Ionen-Akkus der ersten Generationen hatte nur eine kurze Lebensdauer. Teilweise konnten die Nutzer schon nach einem Jahr erhebliche Kapazitätsverluste feststellen; nach zwei bis drei Jahren war so mancher Lithiumionen-Akku bereits unbrauchbar geworden. Dabei stellte sich heraus, dass der schleichende Kapazitätsverlust weniger von der Zahl der Lade-Entlade-Zyklen, sondern vor allem von den Lagerbedingungen abhing: Je höher die Temperatur und je voller der Akku, desto eher kam es zum Ausfall. Als Grund hierfür werden in der Regel parasitäre unumkehrbare chemische Reaktionen genannt.[36]
Bei aktuellen Lithium-Ionen-Akkus liegt die kalendarische Lebensdauer deutlich höher, so dass inzwischen meist die erreichbare Zahl der Lade-/Entladezyklen entscheidet, wie lange der Akku verwendet werden kann.
Die erreichbare Zahl der Lade-/Entladezyklen ist abhängig von Art und Qualität des Akkus, von der Temperatur und von der Art der Nutzung des Akkus, insbesondere (Ent-)Ladehub, Ladeschlussspannung und Stärke der Lade- sowie Entladeströme. Bei hohen Temperaturen verringert sich die Zyklenhaltbarkeit drastisch, weshalb der Akku am besten bei Raumtemperatur verwendet werden sollte. Niedrige Temperaturen während des Betriebs, nicht jedoch während der Lagerung, sind ebenfalls schädlich. Durch flaches Laden und Entladen wird die Haltbarkeit stark überproportional verbessert, das heißt, dass ein Lithium-Ionen-Akku, von dem statt 100 % nur 50 % der maximalen Kapazität entladen und dann wieder geladen werden, mehr als die doppelte Zyklenzahl durchhält. Der Grund hierfür ist, dass bei vollständig entladenem und vollständig geladenem Akku hohe Belastungen für die Elektroden entstehen. Optimalerweise werden bei solchen seicht zyklisierten Akkus sowohl die Ladeschlussspannung reduziert als auch die Entladeschlussspannung erhöht. Ebenso erhöhen starke Lade- und Entladeströme die mechanischen und thermischen Belastungen und wirken sich so negativ auf die Zyklenzahl aus.[37]
Zunehmend werden jedoch auch im Endverbraucherbereich bessere Lithium-Ionen-Akkus mit längerer Haltbarkeit verkauft.
Apple gab 2009 an, die in den neuen Modellen der MacBook Pro Familie verbauten Akkus seien bis zu 1.000 Mal wiederaufladbar, bevor sie nur noch 80 % ihrer ursprünglichen Kapazität erreichten. Das soll einer Verdreifachung der Lebensdauer gegenüber den herkömmlichen Akkus entsprechen.[38] Bei Beachtung der von den schlechten Akkus der ersten Generationen (meist LiCoO2-Akkus) gelernten Anwendungsregeln – Betrieb und Lagerung bei möglichst tiefer Temperatur; Lagerung nur im teilgeladenen Zustand; generell weder ganz geladen noch ganz entladen – könnte die mit den neueren Akkus erzielbare Zyklenzahl auch höher ausfallen. Ein Community-Portal zur Akku-Lebensdauer von Laptop-Akkus nennt bei einer Fallzahl von 1.644 eine durchschnittliche Zyklenzahl von 424 bei 82 % Restkapazität, wobei auch Fälle von 60 % Verlust nach nur 120 Zyklen nicht selten seien.[39]
Bei E-Bike-Batterien zweier namhafter Hersteller konnte der ADAC im Oktober 2015 bei einem Test nach 500 Voll-Ladezyklen noch mindestens 80 % der Gesamtkapazität bestätigen.[40]
Bei Elektrofahrzeugen wurden 2009 mindestens 1.000 bis etwa 3.000 Lade- und Entladezyklen angegeben und 1.000[41] bis 1.750 Zyklen (2020) nachgewiesen.[42] Ende 2019 geht man von 2.000 Zyklen aus.[43]
Wirkungsgrad
- Coulomb-Wirkungsgrad
- Der Coulomb-Wirkungsgrad bzw. die Coulomb-Effizienz beträgt typischerweise annähernd 100 %,[44] das heißt, fast die gesamte in den Akkumulator geflossene Ladung kann diesem auch wieder entnommen werden. Nur während der ersten Zyklen ist die Coulomb-Effizienz geringer, da ein Teil der Lithiumionen mit der Elektrolytlösung an der Anode und Kathode irreversibel unter Ausbildung von Deckschichten reagiert.[45]
- Speichervermögen in Abhängigkeit vom Entladestrom
- Das Speichervermögen in Abhängigkeit vom Entladestrom kann durch die Peukert-Gleichung näherungsweise beschrieben werden. Je höher der Entladestrom, desto weniger elektrische Energie kann dem Akku entnommen werden. Für Lithium-Ionen-Akkus liegt die Peukert-Zahl bei ca. 1,05.
- Energie-Effizienz
- Es kommt – wie bei jedem Akkumulator – zu Energieverlusten durch den Innenwiderstand sowohl beim Laden als auch beim Entladen. Typische Gesamtwirkungsgrade früher Lithium-Cobaltdioxid-Akkumulatoren (vor 2006) betrugen um die 90 %.[44] Werden im Verhältnis zur maximalen Strombelastbarkeit des Akkumulators kleine Lade- und Entladeströme verwendet, können auch über 98 % erreicht werden.
Ladezeit
Wie die Lebensdauer hängt auch die Ladezeit von einigen Faktoren ab, bei höheren Ladeleistungen vor allem von der Temperatur. Kurze Ladezeiten wirken sich belastend auf das Elektrodenmaterial aus, sodass die Lebensdauer und Zyklenzahl verkürzt wird.
Spannung
Ein konventioneller LiCoO2-Akku liefert eine Nennspannung von 3,6 Volt, die damit rund dreimal so hoch wie die eines Nickel-Metallhydrid-Akkumulators (NiMH-Akku) ist. Die Ladeschlussspannung liegt bei bis zu 4,3 Volt. Die Entladeschlussspannung beträgt 2,5 Volt; eine Tiefentladung führt zu irreversibler Schädigung und Kapazitätsverlust. Die Zellenspannung hängt jedoch vom verwendeten Kathodenmaterial ab und ist daher von Akkutyp zu Akkutyp leicht unterschiedlich.[46]
| Material | Spannung |
|---|---|
| LiCoO2 | 3,6 V |
| LiMnO2 | 3,7–3,8 V |
| LiFePO4 | 3,3 V |
| Li2FePO4F | 3,6 V |
Gravimetrische Leistungsdichte
Die Leistungsdichte ist die Leistung, die ein Akkumulator im Verhältnis zu seiner Masse liefert und liegt typischerweise bei 300–1500 W/kg, bei neueren Akkus sind aber auch mehrere Tausend W/kg möglich.[47]
Spezifische Energie und Energiedichte
Die massenbezogene spezifische Energie ist mehr als doppelt so hoch wie beispielsweise die des Nickel-Cadmium-Akkumulators und liegt bei 90–250 Wh/kg, die volumenbezogene Energiedichte liegt bei 200–500 Wh/l, je nach verwendeten Materialien.[48] Anwendungen, die eine besonders lange Lebensdauer benötigen, beispielsweise für den Einsatz in Elektroautos, laden und entladen den Lithium-Ionen-Akku oft nur teilweise (z. B. von 30 bis 80 % statt von 0 bis 100 %), was die Zahl der möglichen Lade-Entlade-Zyklen überproportional erhöht, aber die nutzbare Energiedichte entsprechend reduziert.[46]
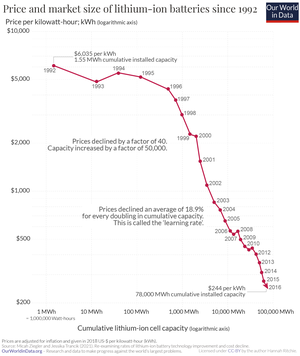
Preis
Die Kosten von Lithium-Ionen-Batterien gehen stetig zurück. Eine weitere Kostensenkung wird sowohl aufgrund von technischen Fortschritten als auch der Erhöhung der Produktionskapazitäten erwartet.[51] Zwischen 1991, als Lithium-Ionen-Akkus in den Markt eingeführt wurden, und 2018 fielen die Zellpreise um 97 %. Der Rückgang betrug im Zeitraum 1992 bis 2016 durchschnittlich 13 % pro Jahr.[52] Zwischen 2010 und 2020 fielen die Kosten von 1100 Dollar/kWh auf durchschnittlich 137 Dollar/kWh; dies ist eine Preisreduktion um 89 %. Erstmals wurden zudem bei einzelnen Batteriepacks für chinesische E-Busse Preise von unter 100 Dollar/kWh erzielt. Die Marke von 100 Dollar/kWh wird per Faustformel als etwa die Schwelle angesehen, bei denen Fahrzeughersteller E-Autos zum gleichen Preis und mit gleicher Marge wie herkömmliche Fahrzeuge mit Verbrennungsmotor verkaufen können. Erwartet wird, dass diese Preise im Durchschnitt im Jahr 2023 erreicht sein werden.[53]
Eine Studie des US-Energieministeriums vom Februar 2017 weist darauf hin, dass die Kosten der Traktionsbatterie, samt Kapselung, Gehäuse, Elektronik und Temperatur-Management, dem Preis der Zellen nur verzögert folgen.[54]
Praxiseinsatz
Wegen der Vielzahl an möglichen Materialien für die negative und positive Elektrode sowie den Separator ist es schwierig, allgemeingültige Aussagen für Lithium-Ionen-Akkus zu treffen. Die verschiedenen Arten werden von den Herstellern für die verschiedensten Einsatzmöglichkeiten optimiert und unterscheiden sich stark.
Ladung
Die Ladeschlussspannung beträgt typischerweise 4,0–4,2 V, teils auch 4,35 V,[55] was etwas höhere Kapazitäten ermöglicht, aber auf Kosten einer reduzierten Zykluszahl. Da Lithium-Ionen-Akkus keinen Memory-Effekt haben und auch nicht formiert werden müssen, werden sie immer auf die gleiche Art geladen: Bei den meisten handelsüblichen Akkus wird bei hochwertigem Ladeverfahren die Ladefunktion nur bei einer Zellenspannung von mindestens 2,5 V aktiviert und bis ca. 2,9 V vorsichtshalber lediglich mit einem Konstantstrom von ca. 0,1 C, darüber mit einem Konstantstrom von ca. 0,3 C (zellenschonende Ladung) bis max. 1 C bis zur Ladeschlussspannung geladen. Schnellladefähige Zellen vertragen je nach Typ aber auch 2 C, 4 C oder gar 8 C.[56] Die Abkürzung C steht hier für den auf die Kapazität bezogenen relativen Ladestrom (d. h. A/Ah)[57] und ist nicht mit der Einheit Coulomb (d. h. As) zu verwechseln; ein Ladestrom von 0,75 C bedeutet, dass ein Akku mit einer Kapazität von 1 Ah mit 0,75 A geladen wird. Generell ist es möglich, Lithium-Ionen-Akkus mit einem geringeren Ladestrom als dem Nennstrom zu laden; meist erhöht sich dadurch auch die erreichbare Zyklenzahl etwas.
Erreicht der Akkumulator die Ladeschlussspannung von z. B. 4,2 V, wird diese Spannung gehalten. Der Ladestrom sinkt dann mit der Zeit immer weiter ab, je voller der Akkumulator wird. Sobald der Strom einen bestimmten Wert (z. B. C/10 oder gar nur 3 Prozent des anfänglichen Stroms) unterschreitet oder er über einen längeren Zeitraum nicht mehr sinkt, wird die Ladung beendet.[46] Die Ladeschlussspannung von produktabhängig 4,1 V bis 4,3 V darf allenfalls mit einer geringen Toleranz (z. B. 50 mV) überschritten werden. Die Verwendung einer etwas niedrigeren Ladeschlussspannung ist hingegen unkritisch. Einer gewissen Verringerung der Kapazität steht meist eine deutliche Erhöhung der Zahl der nutzbaren Lade-Entlade-Zyklen gegenüber.
Ladeanzeige
Mobiltelefone stellen den Ladezustand der enthaltenen Li-Ion-Batterie oft als Prozentangabe dar. Diese Angabe kann allerdings nur als Schätzung angesehen werden, da sie sich in der Regel an der gemessenen Batteriespannung orientiert, welche während der Entladung der Batterie abfällt. Der Zusammenhang zwischen Spannung und noch in der Batterie enthaltenen Energie ist jedoch nicht linear und stellt nur eine Annäherung dar.[58]
Entladung
Die Spannung des Lithium-Ionen-Akkus sinkt während der Entladung zunächst recht schnell von der erreichten Ladeschlussspannung auf die Nennspannung (ca. 3,6 bis 3,7 V) ab, sinkt dann aber während eines langen Zeitraums kaum weiter ab. Erst kurz vor der vollständigen Entladung beginnt die Zellenspannung wieder stark zu sinken.[59] Die Entladeschlussspannung beträgt je nach Zellentyp um die 2,5 V; diese darf nicht unterschritten werden, sonst wird die Zelle durch irreversible chemische Vorgänge zerstört. Viele Elektronikgeräte schalten aber schon bei deutlich höheren Spannungen, z. B. 3,0 V, ab.
Es ist empfehlenswert, Lithium-Ionen-Akkus „flach“ zu (ent-)laden, da sich deren Lebensdauer so verlängert. Wenn ein Lithium-Ionen-Akku immer von 100 % Ladezustand auf 0 % entladen wird, bevor er wieder geladen wird, erreicht er nur die minimale Zyklenzahl. Besser ist es, je nach Typ, z. B. 70 % Entladetiefe anzuwenden. Dies bedeutet, dass der Akku noch 30 % Restkapazität enthält, wenn er wieder geladen wird. Einige Hersteller geben die Zyklenlebensdauer in Abhängigkeit vom Entladungsgrad an.[60]
Generell gilt, dass hohe Entladeströme sowohl die Nennkapazität eines Akkus senken, da dank des höheren Spannungsabfalls am Innenwiderstand die Entladeschlussspannung früher erreicht wird, als auch die Zyklenzahl aufgrund der höheren mechanischen und thermischen Belastung reduzieren. In früheren Veröffentlichungen wird noch auf einen optimalen Entladestrom von 0,2 C (das heißt einem Entladestrom in Höhe von einem Fünftel des Nominalwerts der Nennkapazität in Ah) hingewiesen. Bei einem Akku mit einer Kapazität von 5 Ah wären dies 1 A.[61]
Lagerung/ Selbstentladung
Lithium-Ionen-Akku altern schneller bei höherem Ladezustand und höheren Temperaturen. Vorteilhaft, aber in der Praxis unrealistisch, wäre ein nur wenig geladener, kühl gelagerter, regelmäßig kontrollierter Akku, der vor Benutzung geladen und nach Benutzung gegebenenfalls teilweise wieder zu entladen wäre. Mit viel Aufwand und im entscheidenden Augenblick vielleicht leeren Akku könnte man die Lebensdauer etwas verlängern. Wichtig ist es allerdings, selten genutzte Akkus alle 18 bis 24 Monate auf den Ladezustand zu kontrollieren und nachzuladen, um Tiefentladungen zu verhindern.
Ältere Quellen nennen eine Selbstentladung bei 5 °C von etwa 1 bis 2 %/Monat, bei 20 °C etwa 30 %/Monat.[62] Aktuelle Angaben geben eine Selbstentladung von 3 %/Monat auch bei Zimmertemperatur an.[60] Ein Akku sollte etwa alle sechs Monate auf 55 bis 75 % nachgeladen werden. Lithium-Ionen-Akkumulatoren dürfen sich auch bei Lagerung nicht unter 2,7 V pro Zelle entladen. Eventuell flüssige oder gelförmige Elektrolyte in der Zelle dürfen nicht gefrieren, was einer Mindesttemperatur um −25 °C entspricht.
Sofern es die örtlichen Gegebenheiten zulassen, ist aus Sicherheitsgründen eine Lagerung der Lithiumbatterien im Freien vorteilhaft. Auch ein Brandschutzkonzept sollte vorliegen, da Lithiumbatterien auf Basis von Lithium-Cobalt(III)-oxid thermisch durchgehen können. Widerstandsfähige Stahlbehälter oder Brandschutzschränke können eine Kettenreaktion verhindern, da sie Schutz vor Funken, Flammen, Hitze und Projektilen (Splitter aus einer Explosion einer Batterie) darstellen, insbesondere in Lagerbehältern kommen oftmals noch Löschgranulate zum Einsatz, die einen möglichen Akku-Brand eindämmen. Zusätzlich sollten die Stahlbehälter oder Brandschutzschränke über ein Gasmanagementsystem verfügen. So können bei einem Batteriebrand entstehende Gase sicher aus dem Behälter geführt werden und eine Explosion des Behältnisses unterbunden werden.[63]
Beförderung/ Transport
Jeder Transport einer Lithium-Ionen-Batterie ist ein Gefahrguttransport, völlig unabhängig davon, ob die Batterie beschädigt ist oder nicht. Regelungen des „Europäischen Übereinkommens über die internationale Beförderung gefährlicher Güter auf der Straße“ (ADR), regeln den Transport von neuen und gebrauchten Lithium-Batterien.
Für die Beförderung von Lithium-Akkumulatoren/-Batterien gelten auf Grund der hohen Brandgefahr bei Kurzschluss oder Wasser-Einfluss besondere Sicherheitsvorschriften:
- Einstufung aller Lithium-Batterien seit dem 1. Januar 2009 als Gefahrgut der Klasse 9.[64] Um sie versenden zu dürfen, muss, in der Regel durch den Zell- bzw. Batteriehersteller, zunächst der UN-Transport-Test UN/DOT 38.3[65] (englisch UN Transportation Testing) von einem akkreditierten Prüflabor durchgeführt werden. Hierbei handelt es sich um insgesamt acht Tests. Dieser Test ist zu dokumentieren, ab 2019 (verpflichtend ab 2020) erfolgt dies in einem inhaltlich/ formal vorgegebenen Testbericht (test report).
- für den Straßentransport: das „Europäische Übereinkommen über die internationale Beförderung gefährlicher Güter auf der Straße“ (ADR). Die Übergangsvorschrift gem. 1.6.1.20 ADR findet Anwendung.
- für den Seetransport: der International Maritime Dangerous Goods Code
- für den Lufttransport: die ICAO Technical Instructions (ICAO T.I.) bzw. die IATA Dangerous Goods Regulations (IATA DGR)
- das Gesetz über die Beförderung gefährlicher Güter (GGBefG, Deutschland)
- die „Gefahrgutverordnung Straße, Eisenbahn und Binnenschifffahrt“ (GGVSEB, Deutschland)
- Viele Paketdienste, Fluggesellschaften und Flughäfen haben zusätzlich eigene Beförderungsbestimmungen für Lithium-Ionen-Akkus, wobei kleinere Akkus (ca. < 100 Wh) meist unproblematisch sind. Für den DHL-Versand von Artikeln, die Lithium-Ionen-Akkumulatoren oder Batterien enthalten, gilt z. B. eine Regelung für die Beförderung von gefährlichen Stoffen und Gegenständen.[66]
Grundsätzlich unterscheiden die Gefahrgutvorschriften zwischen "kleinen" und "großen" Lithiumbatterien. Klein bedeutet dabei bei Lithium-Ionen-Batterien eine max. Nennenergie von 20 Wh je Zelle bzw. 100 Wh je Batterie. Bei Lithium-Metall-Batterien gelten Zellen bis 1 g Lithiumgehalt bzw. Batterien bis 2 g Lithiumgehalt als klein. Kleine Zellen/ Batterien unterliegen, entweder einzeln, in oder mit Geräten (Verbrauchern) befördert, erleichterten Bedingungen, während große Zellen/ Batterien gefahrgutrechtlich umfangreicheren Transportbedingungen unterliegen[67]. Die Erleichterungen für kleine Zellen/ Batterien sind im Straßen-, See- und Lufttransport weitestgehend gleich, wobei es für den Lufttransport strengere Anforderungen bzgl. der im Paket zulässigen Batteriemenge gibt. Grundlage ist die Sondervorschrift SV 188 ADR/ IMDG-Code bzw. die entsprechenden Verpackungsanweisungen (packing instructions) PI 965 – PI 970, jeweils Section II. Darüber hinaus wird beim Versand zusätzlich zwischen intakten, (potenziell) defekten / beschädigten Akkus, sowie Akku-Prototypen unterschieden, für die es jeweils abweichende Vorgaben gibt.[68]
Der Versand von Paketen mit kleinen Zellen/ Batterien erfolgt in der Regel mit einer deutlich sichtbaren Kennzeichnung, welche auf den Inhalt hinweist. Sofern es sich um eingebaute Knopfzellen handelt, ist diese Kennzeichnung nicht vorgeschrieben. Ebenfalls ohne Kennzeichnung dürfen Pakete versendet werden, die max. 2 in Geräten eingesetzte kleine Lithiumbatterien enthalten, sofern die Sendung aus nicht mehr als 2 solchen Paketen besteht.
Der Aufkleber enthält Hinweise über/darüber[69]
- das Vorhandensein von Lithium-Ionen-Zellen bzw. Batterien, erkennbar an der aufgeführten UN-Nummer
- dass bei Beschädigung Entzündungsgefahr besteht,
- eine Telefonnummer, bei der man zusätzliche Informationen erhalten kann.
Auch für Lithiumbatterien im Passagiergepäck von Flugreisenden gibt es detaillierte Regelungen, so dürfen beispielsweise einzelne Lithiumbatterien ohne Gerät/ Verbraucher wie Powerbanks oder Ersatzbatterien nicht im aufgegebenen Gepäck transportiert werden, sondern müssen zwingend im Handgepäck mitgeführt werden. Fluggesellschaften sind verpflichtet, ihre Passagiere auf die entsprechenden Regelungen zu Gefahrgut im Gepäck durch Aushänge, Fragen beim Check-In oder deutliche Hinweise beim Check-In im Internet hinzuweisen. Auch die nationalen Luftfahrtbehörden wie das deutsche LBA haben die Bestimmungen dazu veröffentlicht.[70]
Den Transport beschädigter Antriebsakkus muss gemäß ADR die Bundesanstalt für Materialforschung und -prüfung (BAM) genehmigen. Diese legt für jeden Transport individuelle Sicherheitsvorkehrungen fest: neben der Flutung etwa die Verpackung mit nicht brennbaren und temperaturstabilisierenden Dämmstoffen oder die Auffüllung mit nicht leitfähigen und nicht brennbaren Inertstoffen. Laut dem Verband der Bergungs- und Abschleppunternehmen (VBA) gibt es derzeit nur wenige für den Transport defekter E-Autos ausgerüstete Unternehmen.[71]
Entsorgung
Eine fachgerechte Entsorgung ermöglicht die Verwertung der Batterien und damit die Rückgewinnung bestimmter Stoffe wie zum Beispiel Kobalt, Mangan, Nickel, Zink oder Kupfer.[72] Grundsätzlich gilt für die Entsorgung in Deutschland: Die Hersteller sind in der Pflicht, Altbatterien unentgeltlich zurückzunehmen (§ 5 BattG) und nach dem Stand der Technik zu behandeln und stofflich zu verwerten (§ 14 BattG). Im Batteriegesetz sind Anzeige- und Rücknahmepflichten sowie Verwertungsanforderungen festgelegt.[73]
(Integrierte) Elektronik
Lithium-Ionen-Akkus reagieren sehr empfindlich auf falsche Behandlung, weshalb dieser Akkutyp über lange Zeit nicht eingesetzt wurde, obwohl er bereits in den 1980er-Jahren entwickelt worden war.[74] Da integrierte Schaltkreise sehr preisgünstig geworden sind, können Lithium-Ionen-Akkus heute in Verbindung mit einer Elektronik (Batteriemanagementsystem, BMS) betrieben werden, was die Sicherheit im Umgang mit diesem Akkutyp erheblich erhöht hat. Bei Akku-Packs kleiner und mittlerer Baugröße ist diese Elektronik meist integriert; sie dient zum Schutz gegen Tiefentladung, Überladung und thermische Überlastung. Eine selbstrückstellende Sicherung verhindert Überstrom beziehungsweise Kurzschluss. Die verwendete Prozessorsteuerung ist auf die Eigenschaften des jeweiligen Akkutyps abgestimmt. Akku-Packs, in denen zur Spannungserhöhung mehrere Zellen in Reihe geschaltet werden, verfügen oft zusätzlich über eine Elektronik, die durch sog. „Cell-Balancing“ den Ladezustand aller Zellen in einem Pack aneinander angleicht.[75][76] Insbesondere muss die Ladung beendet oder der Ladestrom reduziert werden, wenn die erste Zelle die Maximalspannung überschreitet. Ebenso ist die Entladung zu beenden, wenn die erste Zelle die Minimalspannung unterschreitet.
Überladung
Droht eine Überladung, trennt die Überwachungselektronik die Zelle von der Stromquelle, bis die Elektronik eine Spannungsreduktion erkennt. Nicht alle auf dem Markt erhältlichen Akkus besitzen eine integrierte Überwachungselektronik. Bei Überladung einiger Typen von Lithium-Ionen-Akkus kann metallisches Lithium an der Kathode (Elektrolyse) reduziert werden und sich ablagern oder es wird Sauerstoff aus der Anode (Elektrolyse) freigesetzt. Letzterer gast bestenfalls durch ein Sicherheitsventil aus oder reagiert mit Elektrolyt oder Anode. Dabei heizt sich der Akkumulator auf und kann sogar in Brand geraten.[46] Andere Lithium-Ionen-Akkus wie der LiFePO4-Akku sind thermisch stabil, werden aber bei Überladung ebenfalls irreversibel geschädigt.
Tiefentladung
Zur Verhinderung einer Tiefentladung von Zellen schaltet das Batteriemanagement den Akku temporär ab. Im Falle einer integrierten Schutzelektronik kann dann an den Kontakten des Akkupacks keine Spannung mehr gemessen werden. Der Akku wird von der Schutzelektronik erst wieder an die Kontakte geschaltet, wenn eine äußere (Lade)Spannung anliegt. Ladegeräte, welche die Ladespannung erst freigeben, wenn sie erkennen, dass ein Akku angeschlossen wurde, laden solche Akkus unter Umständen nicht auf.
Tiefentladung führt meist zu irreversibler Schädigung und Kapazitätsverlust. Wenn eine Zelle auf unter 1,5 V entladen wurde, sollte sie nicht mehr verwendet werden, da sich dann mit einiger Wahrscheinlichkeit Brücken ausgebildet haben, die zu einem Kurzschluss führen.
Ladegeräte
Herkömmliche Lithium-Ionen-Akkus dürfen nur mit einer speziellen Ladeschaltung geladen werden. Die Elektronik steuert den ladungsabhängigen Ladestrom und überwacht insbesondere die exakt einzuhaltende Ladeschlussspannung. Auch Akkus mit integrierter Schutzschaltung sollten nur mit passenden Geräten geladen werden. Schnell-Ladegeräte sollten immer unter Aufsicht und möglichst nicht in der Nähe brennbarer Materialien benutzt werden.
Betriebs- und Umgebungstemperatur
Da bei Kälte die chemischen Prozesse (auch die Zersetzung des Akkumulators bei der Alterung) langsamer ablaufen und die Viskosität der in Li-Zellen verwendeten Elektrolyte stark zunimmt, erhöht sich auch beim Lithium-Ionen-Akku bei Kälte der Innenwiderstand, wodurch die entnehmbare Leistung sinkt. Zudem können die verwendeten Elektrolyte bei Temperaturen ab −25 °C einfrieren. Manche Hersteller geben den Arbeitsbereich mit 0–40 °C an. Optimal sind für viele Zellen 18–25 °C. Unter 10 °C kann bei manchen Typen durch den erhöhten Innenwiderstand die Leistung so stark nachlassen, dass ein Gerät mit höherem Strombedarf nur noch einige Minuten betrieben werden kann.
Es gibt Lithium-Ionen-Akkus mit speziellen Elektrolyten, die bis −54 °C eingesetzt werden können. Durch das Laden bei niedrigen Temperaturen tritt meist eine starke Alterung auf, die mit irreversiblem Kapazitätsverlust einhergeht.[77] Aus diesem Grund wird für die meisten Batterien 0 °C als untere zulässige Temperatur während des Ladevorgangs angegeben.
Bei zu hohen Betriebstemperaturen bildet sich bei vielen Systemen durch Zersetzung des Elektrolyts eine Schicht auf der Anode, die den Zellinnenwiderstand erhöht. Die Temperatur während des Entladevorgangs wird von den meisten Herstellern deshalb auf 60 °C limitiert. Lithium-Ionen-Akkumulatoren erwärmen sich während des Entladevorgangs, besonders bei hohen Strömen. Die maximale Temperatur hängt dabei in vielen Fällen linear von der Entladerate ab.[78][79]
Gefahren beim Umgang mit Lithium-Ionen-Akkus
Mechanische Belastung
Mechanische Beschädigungen wie in die Akkuzelle eindringende Objekte können zu inneren elektrischen Kurzschlüssen führen. Die hohen fließenden Ströme führen zur Erhitzung des Akkumulators. Dabei können Gehäuse aus Kunststoff schmelzen und entflammen. Unter Umständen ist ein mechanischer Defekt von außen nicht unmittelbar zu erkennen. Auch längere Zeit nach dem mechanischen Defekt kann es noch zum inneren Kurzschluss kommen. Ebenso kann durch äußere Beschädigung Luft und insbesondere Luftfeuchtigkeit in die Zelle eindringen und unerwünschte chemische Reaktionen hervorrufen.
Chemische Reaktionen

Bei einem geladenen Li-Ion-Akku kann es bei Überhitzung (auch lokal durch Überlastung) oder äußerer Beschädigung zu einem thermischen Durchgehen kommen, bei dem die im Akku gespeicherte Energie in kürzester Zeit durch direkte chemische Reaktion in Form von Wärme frei wird. Dadurch kann es zum Brand kommen, zuvorderst durch den organischen Elektrolyten und seine Zersetzungsprodukte.
Um einen klassischen Metallbrand handelt es sich hier nicht, da die Gesamtmenge an „metallischem“ (in Graphit intercaliertem) Lithium auch im geladenen Zustand nicht sehr groß ist, und durch die kompakte Bauform intern mit dem Metalloxid abreagiert. Gewöhnliche Löschmittel (Schaum, Kohlensäure, bes. Wasser durch die Kühlwirkung) sind daher wirksam und können gefahrlos verwendet werden.[80] Die mögliche Brandgefahr kann zu kostspieligen Rückrufaktionen der Hersteller führen.[81]
Abhilfe
Keramische, temperaturbeständigere Separatoren gewähren eine erhöhte Sicherheit. Ebenso können Zellchemikalien eingesetzt werden, die thermisch stabiler sind oder deren Zersetzung nicht exotherm abläuft. Beispielsweise können statt kostengünstiger Lithium-Cobaltdioxid-Akkumulatoren betriebssichere Lithium-Eisenphosphat-Akkumulatoren eingesetzt werden: Diese weisen allerdings neben einem höheren Preis auch eine geringere Energiedichte auf und erlauben keine derart kompakten Bauformen wie Lithium-Cobaltdioxid-Akkumulatoren.
Weitere unmittelbar in die Zelle integrierte Schutzmaßnahmen betreffen die elektrische Verbindung zwischen dem Elektrodenmaterial und dem äußeren Zellanschluss. Die Verbindung kann so ausgeführt werden, dass sie wie eine Schmelzsicherung wirkt und zusätzlich beim Öffnen etwaiger Berstöffnungen abgerissen wird. Diese zellinternen Schutzmechanismen sind jedoch in der Regel irreversibel ausgeführt. Außer den zellinternen Schutzvorrichtungen gibt es innerhalb moderner Batterien meist weitere elektronische Schutzschaltungen. Deren Funktionen reichen von komplexen Batteriemanagementsystemen (BMS) mit Temperatursensoren, Ladeelektronik, Batteriezustandsüberwachung und externen Kommunikationsanschlüssen (smart batteries) bis zu einfachen, zumeist reversibel wirkenden Sicherheitsschaltungen, die lediglich die Überladung oder Überlastung der Batterie verhindern sollen.
In arbeitswissenschaftlichen Untersuchungen wurde festgestellt, dass der Umgang mit leistungsstarken Lithium-Ionen-Akkumulatoren wie deren Fertigung, Einbau, Lagerung, Entsorgung sowie bestimmte Betriebszustände nur geringe Auswirkungen auf den Arbeitsschutz hat. Die Gefahren wie bei Arbeiten mit höheren elektrische Spannungen und die Handhabung von Gefahrstoffen der eingesetzten Zellchemie können durch Anpassung und konsequente Umsetzung bestehender Sicherheitsanforderungen minimiert werden.[82]
Beispiele von Vorfällen
Im Automobilbau kommt es durch besonders hohe Sicherheitsanforderungen auf Grund der hohen installierten Energiemengen teilweise zu Verzögerungen beim Einsatz. So verschob Opel die Auslieferung des Ampera, als drei Wochen nach einem Crashtest eines baugleichen Chevrolet Volt die versuchsweise nicht ausgebaute, voll geladene Batterie überhitzte und zum Fahrzeugbrand führte.[83] Daraufhin wurde das Sicherheitskonzept der Traktionsbatterie überarbeitet.[84]
Der Umgang mit brennenden Elektroautos stellt Pannendienste und Feuerwehren vor neue Herausforderungen, da z. B. für die Löschung wesentlich mehr Wasser benötigt wird. Zudem ist ein spezieller Kühlcontainer für den Abtransport erforderlich.[85][86][87][88] Ähnlich sieht es bei e-Bikes aus.[89]
Ein interdisziplinäres Wissenschaftsteam der Bundesanstalt für Materialforschung und -prüfung (BAM) untersuchte 2019, welche Stoffe in welchen Mengen im Schadensfall austreten können. Dafür wurde ein Teststand für Brandversuche auf dem Testgelände Technische Sicherheit (TTS) errichtet.[90]
CO2-Bilanz
Bei der Herstellung der Akkumulatoren entsteht Kohlenstoffdioxid. Während frühere Studien zum Ergebnis kamen, dass pro installierter Kilowattstunde Akku-Energiespeichervermögen etwa 70 kg Kohlenstoffdioxid freigesetzt werden[91][92][93], kam eine 2017 erschienene Überblicksstudie über den aktuellen Forschungsstand auf einen Mittelwert von ca. 110 kg pro installierten kWh.[94] Eine 2019 erschienene Überblicksarbeit bezifferte den CO2-Ausstoß bei der Herstellung des am häufigsten verwendeten NMC-Typs auf etwa 61 bis 106 kg CO2-Äquivalente.[95]
Abhängig von verschiedenen Faktoren wie z. B. dem Strommix für die Batterie-Herstellung liegt die Spanne zwischen 38 und 356 kg CO2-eq/kWh. Es existieren verschiedene Möglichkeiten, diese CO2-Emissionen zu reduzieren; beispielsweise durch die Senkung des Gesamtenergiebedarfs oder die Nutzung von Recyclingmaterialien. Als vermutlich erfolgversprechendste Maßnahme hierfür wird die Nutzung von Strom aus erneuerbaren Energien in der Akkuproduktion angesehen.[96]
Nach einer Studie, die im Auftrag der Europäischen Kommission erstellt wurde, können Elektrofahrzeuge bis 2050 fast CO2-frei sein – und zwar unter Berücksichtigung des gesamten Lebensweges von der Herstellung über die Nutzung und das Recycling. Dafür muss der Strom, auch für die Fahrzeugherstellung, aus Erneuerbaren Energien kommen und das Recycling von Batterien muss realisiert sein.[97] Ende 2020 erarbeitete die EU-Kommission eine verpflichtende Nachhaltigkeitsrichtlinie, wonach im Jahr 2026 35 % und 2030 70 % des Lithiums recycelt werden müssen.[98] Bislang müssen Li-Akkus zu 50 Prozent der Masse recycelt werden; dafür genügt mitunter die Demontage der Batterie, Rückführung des Gehäuses und der Kabel. Bei Haushalts-Batterien gilt ein Wert von mindestens 75 Prozent.[99][100] Die etwa 2017 gegründete Firma Düsenfeld im Raum Braunschweig,[101] erreicht einen Wert von 96 Prozent.[102][103]
Umweltauswirkungen
Rohstoffgewinnung
Die Umweltproblematiken von Lithium-Ionen-Batterien werden besonders mit Blick auf die Gewinnung von Lithium aus Salzsee-Solen in südamerikanischen Ländern (Chile, Argentinien) diskutiert.[104][105] Probleme, die sich aus der Li-Extraktion aus Salzseen ergeben, werden vor allem im Zusammenhang mit Wasserknappheit und daraus erwachsenden sozialen Konflikten thematisiert.[106] Seit etwa 2018 wurde jedoch Australien zum weltweit größten Lieferanten von Lithium, wobei Lithium im Festgestein-Bergbau produziert wird. Die beschriebenen Herausforderungen sind auch Motivation für das Recycling.[107]
Recycling
Um Lithium-Ionen-Akkumulatoren und primäre Lithium-Ionen-Batterien zu recyclen, werden verschiedene Grundoperationen zu komplexen Prozessketten kombiniert:[108]
- Deaktivieren/Entladen (speziell für Traktionsbatterien)[109],
- Demontage der Batteriesysteme (speziell für Traktionsbatterien)[109],
- mechanische Prozesse (Schreddern, Sortieren, Sieben etc.[108])[109],
- hydrometallurgische Prozesse sowie
- pyrometallurgische Prozesse.
Kupfer und Aluminium können häufig vergleichsweise einfach durch mechanische Prozessen getrennt und recycelt werden.[110] Kobalt und Nickel können durch pyrometallurgische Prozesse zurückgewonnen werden. Diese Wertstoffe sind für die Prozessökonomie und Prozessökologie besonders attraktiv. Das Recycling sollte mittelfristig umgesetzt werden, um langfristig Engpässe zu vermeiden.[108]
Durch hydrometallurgische Behandlung können Lithiumhydroxid oder Lithiumcarbonat zurückgewonnen werden.[110][111] Bisher (2019) war das recycling jedoch nicht rentabel.[112] Das könnte sich ändern, wenn die Anzahl batteriebetriebener Geräte steigt.[107][109]
Das LithoRec Projekt startete 2009 mit dem Ziel die Entwicklung eines neuen Recyclingverfahrens für Lithium-Ionen-Batterien aus Elektro- und Hybridelektrofahrzeugen mit dem Schwerpunkt auf Energieeffizienz und eine hohe stoffliche Verwertungsquote.[110] Die entwickelte Prozessroute kombiniert mechanische, mild-thermische und hydrometallurgische Behandlung. Ab 2012 wurde die Prozessentwicklung innerhalb einer Testanlage in Braunschweig fortgeführt, in der eine Material-Recycling Rate von 75-80 % pro Batteriesystem erreicht wurde.[111]
Die weltweit erste kommerzielle Recycling-Anlage (PosLX) wurde 2017 von POSCO in Gwangyang, Südkorea, in Betrieb genommen. In dieser Anlage wird Lithiumphosphat aus alten Lithium-Ionen-Akkus durch das von POSCO patentierte Verfahren in Lithiumcarbonat, ein Vorprodukt für Lithium, umgewandelt. Die neue Fabrik hat eine Jahresproduktionskapazität von 2.500 Tonnen Lithiumcarbonat.[113][114] 10.000 Tonnen pro Jahr sämtlicher Arten von Lithium-Ionen-Batterien kann die Anlage der Firma Redux in Bremerhaven bearbeiten.[115][116] Eine weitere der größten Recycling-Anlagen Europas mit 7.000 Tonnen pro Jahr (2018) wird in Antwerpen von Umicore betrieben.[112][117] In Deutschland können 2020 etwa 20.000 Tonnen recycelt werden, was aber bei steigendem Elektrofahrzeug-Aufkommen nicht hinreichend ist.[101]
In einer Studie aus dem Jahr 2020 wird über den Stand und die Perspektiven des Recyclings von Lithium-Ionen-Batterien aus der Elektromobilität berichtet.[118] Die Rückgewinnung von Lithium ist bislang noch in den wenigsten Verfahren realisiert bzw. befindet sich im Entwicklungsstadium. Darüber hinaus gibt es auch Aktivitäten zur Rückgewinnung des Graphits aus den Lithium-Ionen-Batterien. Zu den größten Herausforderungen in den verschiedenen Recyclingprozessen gehört die Beherrschung des Thermische Runaways sowie die hohe Brandlast einer Lithium-Ionen-Batterie.
Ausführungsformen
Zellchemie
Materialien an der Pluspolseite
| Bezeichnung | (+)-Elektrodenmaterialien[119] | Abkürzungen | Zell-Spannung | typ. Betriebsbereich | Laden (Ladeschluss-Spannung) | Entladen (Cut-Off Spannung) | Spezifische Energie | Ladezyklen |
|---|---|---|---|---|---|---|---|---|
| Lithium-Cobaltdioxid-Akkumulator | LiCoO2 | ICR, LCO | 3,6 V | 3,0-4,2 V | 0,7-1C (4,2 V) | ≤ 1C (2,5 V) | 150-200 Wh/kg | 500-1000 |
| Lithium-Mangan-Akkumulator | LiMnO2 / LiMn2O4 | IMR, LMO, LMS | 3,7-3,8 V | 3,0-4,2 V | 0,7-1C (4,2 V) | 1C, manche Zellen 10C (2,5 V) | 100-150 Wh/kg | 300-700 |
| Lithium-Nickel-Mangan-Cobalt-Akkumulator | LiNixMnyCozO2 | INR, NMC, NCM | 3,6-3,7 V | 3,0-4,2 V | 0,7-1C (4,2 V) | 1C, manche Zellen 2C (2,5 V) | 150-220 Wh/kg | 1000-2000 |
| Lithium-Nickel-Cobalt-Aluminium-Akkumulator | LiNixCoyAlzO2 | NCA | 3,6 V | 3,0-4,2 V | 0,7C (4,2 V) | 1C (3,0 V) | 200-260 Wh/kg | 500 |
| Lithium-Eisenphosphat-Akkumulator | LiFePO4 | IFR, LFP | 3,2-3,3 V | 2,5-3,65 V | 1C (3,65 V) | 1C, manche Zellen 25C (2,5 V) | 90-120 Wh/kg | 2000 und mehr |
Materialien auf der Minuspolseite
| Bezeichnung | (−)-Elektroden-material | Abkürzungen | Zell-Spannung | typ. Betriebsbereich | Laden (Ladeschluss-Spannung) | Entladen (Cut-Off Spannung) | Spezifische Energie | Ladezyklen |
|---|---|---|---|---|---|---|---|---|
| Lithium-Graphit-Akkumulator (Standard-Lithium-Ionen-Zelle) | C | C | 3,2 V-4,0 V | 3,4-3,8 V | 1C | bis zu 10C | ||
| Lithiumtitanat-Akkumulator | Li4Ti5O12 | LTO | 2,4 V | 1,8-2,85 V | 1C (2,85 V) | bis zu 10C (2,5 V) | 50-80 Wh/kg | 3000-7000 |
Elektrolyte
Alle genannten Elektrodenmaterialien können mit einem Polymerelektrolyten kombiniert werden, so dass ein Lithium-Polymer-Akkumulator entsteht. Üblich sind flüssige Elektrolyte in einem porösen Separator.
Lithium-Cobaltdioxid-Akkumulator
Bei dem Lithium-Cobaltdioxid-Akkumulator besteht die positive Elektrode aus dem namensgebenden Lithium-Cobalt(III)-oxid (LiCoO2). Nahezu alle handelsübliche Mobilelektronik verwendet Lithium-Cobaltdioxid-Akkumulatoren.
Lithium-Nickel-Mangan-Cobalt-Akkumulator
Lithium-Nickel-Mangan-Cobalt-Oxide, kurz NMC oder auch NCM genannt, haben sich zum wichtigsten Material entwickelt, das in Traktionsbatterien verwendet wird. Die meisten Elektroautos einschließlich derer von Daimler oder BMW, aber abgesehen von den Produkten von Tesla und einigen chinesischen Herstellern, verwenden mit Stand 2019 NMC-Akkumulatoren.
Lithium-Nickel-Cobalt-Aluminium-Akkumulator
Der Lithium-Nickel-Cobalt-Aluminium-Akkumulator ist eine Version des Lithium-Ionen-Akkumulators mit Lithium-Nickel-Cobalt-Aluminium-Oxid (LiNixCoyAlzO2, NCA) als Kathodenmaterial. Dieser Akku zeichnet sich durch hohe Energiedichte (240–270 Wh/kg bei zyl. Zellen im Format 18650) und lange Lebensdauer aus. NCA-Zellen werden als Traktionsbatterie vor allem von Panasonic und Tesla hergestellt.
Lithium-Mangan-Akkumulator
Beim Lithium-Mangan-Akkumulator wird Lithiummanganoxid als Aktivmaterial in der positiven Elektrode eingesetzt. Die negative Elektrode, bei Entladung des Akkumulators die Anode, besteht entweder aus herkömmlichem Graphit (Hochenergiezellen) oder aus einer amorphen Kohlenstoffstruktur (
, in Hochleistungszellen). Durch die größere Anodenoberfläche ergibt sich eine verbesserte Hochstromfestigkeit. Die Zellen werden mit Stand 2012 sowohl in Pedelecs und E-Bikes verschiedener Hersteller (u. a. vom Schweizer Pedelec-Hersteller Flyer[120][121]), als auch in Hybridelektrokraftfahrzeugen (Bsp.: Nissan Fuga Hybrid, Infinity Mh) und Elektroautos (Bsp.: Nissan Leaf) eingesetzt. Großformatige Zellen für Traktionsbatterien fertigt beispielsweise AESC für Nissan.
Lithium-Eisenphosphat-Akkumulator
Der Lithium-Eisenphosphat-Akkumulator (LiFePO4-Akkumulator) ist eine Version des Lithium-Ionen-Akkumulators, bei dem die herkömmliche Lithium-Cobaltoxid-Kathode durch eine Lithium-Eisenphosphat-Kathode ersetzt wurde. Dieser Akku zeichnet sich durch hohe Lade- und Entladeströme, eine sehr gute Temperaturstabilität und eine lange Lebensdauer aus. Die Nominalspannung beträgt 3,2 V beziehungsweise 3,3 V, die Energiedichte beträgt 100–120 Wh/kg
Weiterentwicklungen zur Verbesserung der technischen Eigenschaften sind Dotierungen mit Yttrium- (LiFeYPO4) und Schwefelatomen.
Lithiumtitanat-Akkumulator
Der Lithiumtitanat-Akkumulator ist eine Unterkategorie des Lithium-Ionen-Akkumulators, bei der die herkömmliche Graphitelektrode (negativer Pol) durch eine gesinterte Elektrode aus Lithiumtitanspinell (Li4Ti5O12) ersetzt wird. Die wesentlich stärkere chemische Bindung des Lithiums im Titanat verhindert die Bildung einer Oberflächenschicht, die eine der Hauptgründe für die schnelle Alterung vieler herkömmlicher Li-Ion-Akkus ist. Dadurch wird die Zahl der möglichen Ladezyklen erhöht. Da das Titanat nicht mehr mit Oxiden aus der Kathode reagieren kann, wird auch das thermische Durchgehen des Akkumulators verhindert, selbst bei mechanischen Schäden. Außerdem kann der Akkumulator aufgrund der Lithiumtitanat-Anode im Gegensatz zu herkömmlichen Lithium-Ionen-Akkus auch bei tiefen Temperaturen in einem Temperaturbereich von −40 bis +55 °C betrieben werden. Nachteilig ist die geringe Speicherdichte und der hohe Preis.
Weitere Akkumulatortypen
Beim Dual-Carbon-Akkumulator bestehen beide Elektroden, sowohl die Kathode als auch die Anode, aus porösem Graphit. Dieser Akkumulatortyp befindet sich im Forschungsstadium und hat mit Stand 2019 noch keine wirtschaftliche Bedeutung. Er gehört nicht zu den Lithiumionenzellen im engeren Sinn, weil beim Entladen nicht wie üblich an der Pluspolseite Li+-Ionen eingelagert werden.
Spezielle Bauweisen
Lithium-Polymer-Akkumulator
Der Lithium-Polymer-Akkumulator stellt keine eigenständige Zellchemie dar, wenngleich die Mehrzahl aller am Markt befindlichen Lithium-Polymer-Akkumulatoren vom Typ der Lithium-Cobaltdioxid-Akkumulatoren sind und damit umgangssprachlich oft gleichgesetzt werden. Die wesentliche Eigenschaft des Polymer-Akkumulators ist die Art der Gestaltung des normalerweise flüssigen Elektrolyts, welcher als feste bis gelartige Folie auf Polymerbasis vorliegt und somit im mechanischen Aufbau der Zelle verschiedenartige Gestaltungen wie den Aufbau flacher Zellen erlaubt. Die äußere Form der Lithium-Polymer-Akkus unterliegt praktisch keinen Beschränkungen.
Verschiedenartige Materialkombinationen
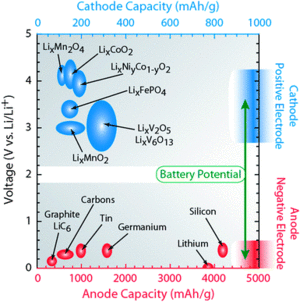
Es stehen zahlreiche Materialkombinationen zur Speicherung von Lithiumionen zur Verfügung. Die chemischen Speichermaterialien verändern die Eigenschaften des Akkumulators entscheidend, so dass diese zur Einstellung auf spezielle Anforderungen genutzt werden können. Die Abbildung zeigt zahlreiche Kathoden- und Anodenmaterialien in einer Gegenüberstellung und weist den Potentialunterschied der Materialien aus.
Durch die zusätzliche Verwendung unterschiedlicher spezieller Separatoren (z. B. Keramikseparatoren),[122] Elektrolyte (z. B. Ionische Flüssigkeiten) und Verpackungsmaterialien können weitere Eigenschaften des Akkumulators eingestellt werden, so dass diese auch extremen Anforderungen gerecht werden können.
Als besondere Anforderungen an Lithium-Ionen-Akkumulatoren gelten:
- Maximierung von Energiedichte (gewichts- oder volumenbezogen);
- Schnellladefähigkeit und Leistungsdichte;
- Hoch- und Niedrigtemperaturfestigkeit;
- Stoßfestigkeit und Eigensicherheit;
- Strahlungstoleranz (z. B. Gammastrahlung in der Luft- und Raumfahrt);
- Hoch- und Niederdruckfestigkeit (bis Grobvakuum);
- Spezielle Formfaktoren für Folienkörper oder Anschlusspole;
- Amagnetismus sowie
- Biegeflexibilität.
Obwohl diese Möglichkeiten bestehen, stützt sich die industrielle Massenfertigung auf die Verwendung von etablierten Speichermaterialien, wie z. B. Lithium-Cobalt(III)-oxid und Graphit. Nur wenige Spezialhersteller, wie z. B. das deutsche Unternehmen Custom Cells Itzehoe GmbH und das amerikanische Unternehmen Yardney Technical Products Inc., bieten Sonderlösungen an. Nebenstehende Abbildung zeigt einen vom Fraunhofer-Institut für Siliziumtechnologie (ISIT) entwickelten Akkumulator, der in seiner Energiedichte, Druckresistenz und ungewöhnlichen Formgebung (sechseckig) für den Einsatz in einem Autonomen Unterwasserfahrzeug (AUV)) optimiert wurde.[123][124]
Literatur
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren. Mobile Energiequellen für heute und morgen. Springer, Berlin 1998, ISBN 3-540-62997-1.
- Jeff Dahn, Grant M. Ehrlich: Lithium-Ion Batteries. In: Thomas B. Reddy (Hrsg.): Linden's Handbook of Batteries. 4. Auflage. McGraw-Hill, New York 2011, ISBN 978-0-07-162421-3, Kapitel 26
- Claus Daniel, Jürgen O. Besenhard: Handbook of Battery Materials. Wiley-VCH, Weinheim 2011, ISBN 3-527-32695-2.
- Masaki Yoshio, Ralph J. Brodd, Akiya Kozawa (Hrsg.): Lithium-Ion Batteries. Science and Technologies. Springer, New York 2009, ISBN 978-0-387-34444-7.
- Reiner Korthauer (Hrsg.): Handbuch Lithium-Ionen-Batterien. Heidelberg: Springer Vieweg, Berlin 2013, ISBN 978-3-642-30653-2.
- Peter Kurzweil, Otto K. Dietlmeier: Elektrochemische Speicher. Springer Vieweg, Wiesbaden 2015, ISBN 978-3-658-10900-4.
- P. Birke, M. Schiemann: Akkumulatoren: Vergangenheit, Gegenwart und Zukunft elektrochemischer Energiespeicher. H. Utz Verlag, München 2013, ISBN 978-3-8316-0958-1, Kapitel 3.1.: Lithium-Ionen-Akkumulatoren. S. 192–235.
- Dell, Rand: Understanding Batteries. Royal Society of Chemistry, 2001, ISBN 0-85404-605-4, S. 147–153, Kapitel 10.4: The Lithium-ion Battery.
- M. Winter, J. O. Besenhard: Wiederaufladbare Batterien. In: Chemie in unserer Zeit, Jg. 1999, Bd. 33, S. 252 und 320.
- Claudia Borchard-Tuch: Lithium-Ionen-Akkus. In: Chemie in unserer Zeit, Jg. 2003, Bd. 37, Heft 6, S. 436–437.
Weblinks
- Kompendium: Li‐Ionen‐Batterien (Stand Juli 2015, PDF; 1,2 MB) BMWi Förderprogramm IKT für Elektromobilität II
- Skript über diverse Typen von Lithium-Batterien (Stand Feb. 2005, PDF; 3,4 MB) TU Graz, Institut für Chemische Technologie Anorganischer Stoffe
- Batterieforum Deutschland, Infoportal mit Links zum allgemeinen Batterie-Kompendium und Lexikon
- Kompendium: Lithium-Ionen-Batterien des Batterieforums Deutschland
Einzelnachweise
- ↑ Xin Sun, Xiaoli Luo, Zhan Zhang, Fanran Meng, Jianxin Yang: Life cycle assessment of lithium nickel cobalt manganese oxide (NCM) batteries for electric passenger vehicles. In: Journal of Cleaner Production. Band 273. Elsevier, November 2020, ISSN 0959-6526, S. 123006, doi:10.1016/j.jclepro.2020.123006 (elsevier.com).
- ↑ Grant M. Ehrlich: Handbook Of Batteries. Hrsg.: David Linden, Thomas B. Reddy. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 35: Lithium-Ion Batteries, S. 35.1–35.94.
- ↑ Grant M. Ehrlich: Handbook Of Batteries. Hrsg.: David Linden, Thomas B. Reddy. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 35: Lithium-Ion Batteries, S. 35.2.
- ↑ Grant M. Ehrlich: Handbook Of Batteries. Hrsg.: David Linden, Thomas B. Reddy. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 35: Lithium-Ion Batteries, S. 35.3.
- ↑ Grant M. Ehrlich: Handbook Of Batteries. Hrsg.: David Linden, Thomas B. Reddy. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 35: Lithium-Ion Batteries, S. 35.8–35.9.
- ↑ Peter J. Bugryniec, Jonathan N. Davidson, Solomon F. Brown: Assessment of thermal runaway in commercial lithium iron phosphate cells due to overheating in an oven test. In: Energy Procedia. Band 151, Oktober 2018, ISSN 1876-6102, S. 74–78, doi:10.1016/j.egypro.2018.09.030.
- ↑ Thomas B. Reddy, Sohrab Hossain: Handbook Of Batteries. Hrsg.: David Linden, Thomas B. Reddy. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 34: Rechargeable Lithium Batteries (Ambient Temperature), S. 34.1–34.4.
- ↑ Naoki Nitta, Feixiang Wu, Jung Tae Lee, Gleb Yushin: Li-ion battery materials: present and future. In: Materials Today. Band 18, Nr. 5, 1. Juni 2015, S. 252–264, doi:10.1016/j.mattod.2014.10.040 (sciencedirect.com [abgerufen am 25. März 2017]).
- ↑ Jang-Yeon Hwang, Seung-Taek Myung, Yang-Kook Sun: Sodium-ion batteries: present and future. In: Chemical Society Reviews. Band 46, Nr. 12, Juni 2017, S. 3529 – 3614, doi:10.1039/C6CS00776G.
- ↑ Frank Wunderlich-Pfeiffer: Ausnahmsweise ein echter Durchbruch in der Akkutechnik. In: Golem.de. 17. Juni 2020, abgerufen am 25. November 2020.
- ↑ J. O. Besenhard, H. P. Fritz: Cathodic reduction of graphite in organic solutions of alkali and NR4+ salts. In: Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. Band 53, Nr. 2, 25. Juni 1974, S. 329–333, doi:10.1016/S0022-0728(74)80146-4.
- ↑ J. O. Besenhard: The Electrochemical Preparation and Properties of Ionic Alkali Metal and NR4 Graphite Intercalation Compounds in Organic Electrolytes. In: Carbon. Band 14, Nr. 2, 1976, S. 111–115, doi:10.1016/0008-6223(76)90119-6.
- ↑ R. Schöllhorn, R. Kuhlmann, J. O. Besenhard: Topotactic redox reactions and ion exchange of layered MoO3 bronzes. In: Materials Research Bulletin. Band 11, Nr. 1, Januar 1976, S. 83–90, doi:10.1016/0025-5408(76)90218-X.
- ↑ J. O. Besenhard, R. Schöllhorn: The discharge reaction mechanism of the MoO3 electrode in organic electrolytes. In: Journal of Power Sources. Band 1, Nr. 3, 1976, S. 267–276, doi:10.1016/0378-7753(76)81004-X.
- ↑ J. O. Besenhard, G. Eichinger: High energy density lithium cells: Part I. Electrolytes and anodes. In: Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. Band 68, Nr. 1, 25. Februar 1976, S. 1–18, doi:10.1016/S0022-0728(76)80298-7.
- ↑ G. Eichinger, J. O. Besenhard: High energy density lithium cells: Part II. Cathodes and complete cells. In: Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. Band 72, Nr. 1, 25. August 1976, S. 1–31, doi:10.1016/S0022-0728(76)80072-1.
- ↑ a b c Würdigung für den Nobelpreis für Chemie 2019. nobelprize.org
- ↑ M. Stanley Whittingham: Lithium Batteries and Cathode Materials. In: Chemical Reviews. Band 104, Nr. 10, Oktober 2004, ISSN 0009-2665, S. 4271–4302, doi:10.1021/cr020731c (acs.org).
- ↑ a b c Heng Zhang, Chunmei Li, Gebrekidan Gebresilassie Eshetu, Stéphane Laruelle, Sylvie Grugeon: From Solid‐Solution Electrodes and the Rocking‐Chair Concept to Today's Batteries. In: Angewandte Chemie. Band 132, Nr. 2. Wiley-VCH, 7. Januar 2020, ISSN 0044-8249, S. 542–546, doi:10.1002/ange.201913923 (wiley.com).
- ↑ M. Lazzari, Bruno Scrosati: A Cyclable Lithium Organic Electrolyte Cell Based on Two Intercalation Electrodes. In: Journal of The Electrochemical Society. Band 127, Nr. 3, 1. März 1980, ISSN 0013-4651, S. 773–774, doi:10.1149/1.2129753 (iop.org).
- ↑ K. Mizushima, P. C. Jones, P. J. Wiseman, J. B. Goodenough: LixCoO2 (0 < x < l): A New Cathode Material For Batteries Of High Energy Density. In: Materials Research Bulletin. Band 15, 1980, S. 783–789, doi:10.1016/0025-5408(80)90012-4.
- ↑ Akku für Sony CCD Tr1. In: akku-gebiet.de. Abgerufen am 4. März 2012.
- ↑ Leveraging Cation Identity to Engineer Solid Electrolyte Interphases for Rechargeable Lithium Metal Anodes. In: Cell Reports Physical Science. 4. November 2020, ISSN 2666-3864, S. 100239, doi:10.1016/j.xcrp.2020.100239 (sciencedirect.com [abgerufen am 6. November 2020]).
- ↑ Akkus: Forscher verbessern Lithium-Batterien. In: DER SPIEGEL. Abgerufen am 6. November 2020.
- ↑ Ralph Diermann: Das Rennen um die Batterie der Zukunft. In: Der Spiegel. 9. Februar 2020, ISSN 2195-1349 (spiegel.de [abgerufen am 3. November 2021]).
- ↑ Memory-Effekt bei Lithium-Ionen-Akkus. heise online, 15. April 2013, abgerufen am 17. Januar 2017.
- ↑ M. Wohlfahrt-Mehrens, C. Vogler, J. Garche: Aging mechanisms of lithium cathode materials. In: Journal of Power Sources. 127, Nr. 1–2, 2004, S. 58–64, doi:10.1016/j.jpowsour.2003.09.034.
- ↑ Sébastien Patoux, Lucas Sannier, Hélène Lignier, Yvan Reynier, Carole Bourbon, Séverine Jouanneau, Frédéric Le Cras, Sébastien Martinet,: High voltage nickel manganese spinel oxides for Li-ion batteries. In: Electrochimica Acta. Band 53, Nr. 12, Mai 2008, S. 4137–4145, doi:10.1016/j.electacta.2007.12.054.
- ↑ Gaurav Sharma, Yi Jin, Y. S. Lin: Lithium Ion Batteries with Alumina Separator for Improved Safety. In: Journal of The Electrochemical Society. Band 164, Nr. 6, 1. Januar 2017, ISSN 0013-4651, S. A1184–A1191, doi:10.1149/2.1091706jes (ecsdl.org [abgerufen am 18. Juni 2018]).
- ↑ Li-ion 21700: LG M50 5000mAh vs Samsung 48G 4800mAh discharge capacity test in thunderheartreviews.com, abgerufen am 2. Januar 2020.
- ↑ Thomas Kuther: 21700er-Akku-Rundzellen: oft die bessere Alternative. In: Elektronik Praxis. 5. Februar 2020, abgerufen am 27. Juni 2021.
- ↑ Manne Schmitt: Leistungsfähigere und zugleich günstigere Batterien – Nicht nur für Tesla, sondern auch für E-Bikes? In: E-Mountainbike. 1. Oktober 2020, abgerufen am 27. Juni 2021.
- ↑ electrive.net vom 2. Januar 2021, Panasonic: Bau der 4680-Batteriezelle für Tesla soll 2021 starten, abgerufen am 24. Juni 2021.
- ↑ Isidor Buchmann: Ist Lithium-Ion die ideale Batterie? (Nicht mehr online verfügbar.) In: Plattform für die Förderung und Verbreitung von Elektrofahrzeugen. Archiviert vom Original am 22. November 2015; abgerufen am 17. Dezember 2011.
- ↑ Thomas Schmalz: Akkumulatortechnologien im Modellbau. Oktober 2013.
- ↑ Isidor Buchmann: Will Lithium-Ion batteries power the new millennium? (Memento vom 17. Oktober 2015 im Internet Archive) September 2008.
- ↑ Richard L. Hartmann II, An aging model for lithium-ion cells. S. 75–79, Dissertation an der University of Akron (PDF; 3,4 MB), abrufbar am 15. Oktober 2021.
- ↑ https://www.apple.com/de/newsroom/2009/06/08Apple-Updates-MacBook-Pro-Family-with-New-Models-Innovative-Built-in-Battery-for-Up-to-40-Percent-Longer-Battery-Life/ In: apple.com. 8. Juni 2009, abgerufen am 31. Juli 2017.
- ↑ https://macbookbatterydatabase.com/, abgerufen am 1. August 2017.
- ↑ Teure Pedelec-Batterien und ihre Haltbarkeit 10/2015. In: adac.de. Oktober 2015, abgerufen am 15. Oktober 2021.
- ↑ B. Ketterer, U. Karl, D. Möst, S. Ulrich (Forschungszentrum Karlsruhe): Lithium-Ionen Batterien: Stand der Technik und Anwendungspotenzial in Hybrid-, Plug-In Hybrid- und Elektrofahrzeugen, Seite 47 mit Anhang 10. In: publikationen.bibliothek.kit.edu. Oktober 2009, abgerufen am 15. Oktober 2021.
- ↑ Steffen Wienands, Berner Fachhochschule: Die Lithium-Ionen-Batterie – Grundlagen, Anwendungen und Zukunftsperspektiven, Seite 12 (PDF). 6. Dezember 2020, abgerufen am 15. Oktober 2021.
- ↑ Jens Tartler: Wenn elf Avocados umweltschädlicher als eine E-Auto-Batterie sind. In: tagesspiegel.de. 4. Dezember 2019, abgerufen am 15. Oktober 2021.
- ↑ a b Life-Cycle Testing of Mars Surveyor Program Lander Lithium Ion Battery Achieved Over 10,000 Low-Earth-Orbit Cycles. (Memento vom 9. September 2013 im Internet Archive) In: NASA.gov, 16. Oktober 2006.
- ↑ PDF bei www.et-inf.fho-emden.de (Memento des Originals vom 12. April 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ a b c d Charging lithium-ion batteries. In: BORDER RADIO CLUB Newsletter. März 2006.
- ↑ E-One Moli Energy: Ankündigung einer neuen Zelle (Memento vom 11. März 2007 im Internet Archive); Lithium-Ionen-Akku: ITWissen.info (4. September 2016)
- ↑ Kurzweil, Dietlmeier: Elektrochemische Speicher S. 223 Tab. 318.
- ↑ Micah S. Ziegler, Jessika E. Trancik: Re-examining rates of lithium-ion battery technology improvement and cost decline. In: Energy & Environmental Science. Band 14, Nr. 4, 2021, ISSN 1754-5692, S. 1635–1651, doi:10.1039/D0EE02681F (rsc.org [abgerufen am 26. April 2022]).
- ↑ The price of batteries has declined by 97% in the last three decades. Abgerufen am 26. April 2022.
- ↑ Nancy Haegel et al: Terawatt-scale photovoltaics: Transform global energy. In: Science. Band 364, Nr. 6443, 2019, S. 836–838, doi:10.1126/science.aaw1845.
- ↑ Micah S. Ziegler, Jessika E. Trancik: Re-examining rates of lithium-ion battery technology improvement and cost decline. In: Energy and Environmental Science. 2021, doi:10.1039/d0ee02681f.
- ↑ Battery Pack Prices Cited Below $100/kWh for the First Time in 2020, While Market Average Sits at $137/kWh. In: Bloomberg, 16. Dezember 2020. Abgerufen am 12. Februar 2021.
- ↑ Cost and Price Metrics for Automotive Lithium-Ion Batteries. (PDF) In: energy.gov. Februar 2017, abgerufen am 1. August 2017.
- ↑ LiIon: viele Zellen haben Ladeschlussspannung von 4,35 V! ALC Update geplant?, elv.de, 2013.
- ↑ Produktbeschreibung SCiB von Toshiba (Memento vom 27. August 2010 im Internet Archive)
- ↑ Akkus: Kurzlebig ab Werk. (Memento vom 24. Mai 2009 im Internet Archive) In: TecChannel.de. S. 4 von 15
- ↑ Lance Ulanoff: Why your iPhone battery meter sometimes goes haywire - Your iPhone battery meter is (probably) lying to you. Abschnitt Fuzzy Science, 5. Februar 2017. In: Mashable.com
- ↑ Lithium-Ionen-Akku. In: qsl.net.
- ↑ a b Winston Battery: WB-LYP100AHA. Datenblatt LiFePO4-Zelle 3,2 V 100 Ah, eingefügt am 11. Februar 2012.
- ↑ Bernhard Haluschak: Akkus: Kurzlebig ab Werk. (Memento vom 24. Juni 2008 im Internet Archive) In: Tecchannel. 23. September 2005.
- ↑ M. Frehner, 2007: Alles über Akkus Abschnitt: Selbstentladung. In: funkcom.ch, abgerufen am 15. Februar 2012.
- ↑ Erhöhte Brandgefahr in Krankenhäusern: Lagerungsproblematik Lithium-Ionen-Batterien. Abgerufen am 27. Juni 2019 (deutsch).
- ↑ UN-Transportverordnung für Lithiumbatterien. Abgerufen am 8. März 2017.
- ↑ Lithium Battery Testing Under UN/DOT 38.3. (PDF) TÜV Süd America, abgerufen am 11. März 2017 (englisch).
- ↑ Regelung für die Beförderung von gefährlichen Stoffen und Gegenständen. (Memento vom 9. Mai 2012 im Internet Archive) DHL Vertriebs GmbH & Co OHG Marktkommunikation (PDF; 132 kB)
- ↑ SV 188. Abgerufen am 10. Februar 2019.
- ↑ Versandklassen von Lithium-Ionen-Akkus / Lithium-Batterien. Abgerufen am 21. März 2022.
- ↑ ADR 2019 – Unterabschnitt 5.2.1.9
- ↑ Luftfahrt Bundesamt – Passagiergepäck. Abgerufen am 10. Februar 2019.
- ↑ Entsorgung von E-Autos: Wer trägt die Verantwortung? In: Sonderabfallwissen. 1. August 2020, abgerufen am 25. November 2020.
- ↑ Erhöhte Brandgefahr in Krankenhäusern: Lagerungsproblematik Lithium-Ionen-Batterien. Abgerufen am 27. Juni 2019 (deutsch).
- ↑ BattG – Gesetz über das Inverkehrbringen, die Rücknahme und die umweltverträgliche Entsorgung von Batterien und Akkumulatoren. Abgerufen am 27. Juni 2019.
- ↑ Isidor Buchmann: Wann wurde die Batterie erfunden? (Memento vom 22. Januar 2012 im Internet Archive) In: Batterien-Montage-Zentrum GmbH.
- ↑ Battery Management Systems (BMS). In: Electropaedia.
- ↑ Multi-Cell Li-ion Battery Pack OCP/Analog Front End bei intersil (Memento des Originals vom 1. April 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Thomas Waldmann, Marcel Wilka, Michael Kasper, Meike Fleischhammer, Margret Wohlfahrt-Mehrens: Temperature dependent ageing mechanisms in Lithium-ion batteries – A Post-Mortem study. In: Journal of Power Sources. Band 262, 2014, S. 129–135, doi:10.1016/j.jpowsour.2014.03.112.
- ↑ Thomas Waldmann, Margret Wohlfahrt-Mehrens: In-Operando Measurement of Temperature Gradients in Cylindrical Lithium-Ion Cells during High-Current Discharge. In: ECS Electrochemistry Letters. Band 4, 2015, S. A1–A3, doi:10.1149/2.0031501eel.
- ↑ Thomas Waldmann, Gunther Bisle, Björn-Ingo Hogg, Stefan Stumpp, Michael A. Danzer, Michael Kasper, Peter Axmann, and Margret Wohlfahrt-Mehrens: Influence of Cell Design on Temperatures and Temperature Gradients in Lithium-Ion Cells: An In Operando Study. In: Journal of The Electrochemical Society. Band 162, 2015, S. A921–A927, doi:10.1149/2.0561506jes.
- ↑ DGUV: FAQ-Liste der AG „Handlungsrahmen Elektromobilität“. (PDF) 1. August 2016, abgerufen am 14. März 2019.
- ↑ Gigaset ruft Telefon-Akkus wegen Überhitzung zurück. In: heise online. 15. Dezember 2011, abgerufen am 17. Januar 2017.
- ↑ Elektromobilität – Abschätzung arbeitswissenschaftlich relevanter Veränderungen In: baua.de, Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, 2012, abgerufen am 28. März 2012.
- ↑ ssu: Opel verkauft vorerst keinen Ampera. In: heise.de. 14. Dezember 2011, abgerufen am 11. Mai 2022.
- ↑ Opel-Mutterkonzern kriegt Flammengefahr in den Griff. In: Spiegel Online. 6. Januar 2012, abgerufen am 13. Februar 2012.
- ↑ Elektroauto an Tankstelle in Ratingen brennt vollkommen aus. In: nrz.de. 19. September 2019, abgerufen am 21. Oktober 2019.
- ↑ Jörn Kerckhoff: Mobilitätswende: Wenn Elektroautos brennen. In: moz.de. 25. September 2019, abgerufen am 21. Oktober 2019.
- ↑ Pannendienste müssen aufrüsten wegen E-Autos. In: 20min.ch. 18. Oktober 2019, abgerufen am 19. Oktober 2019.
- ↑ Elektroauto auf der A4 in Brand geraten – Strecke zwischen Goldau und Küssnacht war gesperrt. In: luzernerzeitung.ch. 21. Oktober 2019, abgerufen am 21. Oktober 2019.
- ↑ Akku-Brand bei Lastenrad: Feuerwehr muss Elektro-Bike in Container tauchen. In: Focus Online. 17. September 2021, abgerufen am 11. Mai 2022.
- ↑ Damit Lithium-Batterien sicher unterwegs sind. Bundesanstalt für Materialforschung und -prüfung (BAM), 24. April 2019, abgerufen am 25. November 2020.
- ↑ M. Armand, J.-M. Tarascon: Building better batteries. In: Nature. Band 451, 2008, S. 652–657, doi:10.1038/451652a.
- ↑ Boucar Diouf, Ramchandra Pode: Potential of lithium-ion batteries in renewable energy. In: Renewable Energy. Band 76, 2015, S. 375–380, doi:10.1016/j.renene.2014.11.058.
- ↑ D. Larcher, J-M. Tarascon: Towards greener and more sustainable batteries for electrical energy storage. In: Nature Chemistry. Band 7, 2015, S. 19–29, doi:10.1038/NCHEM.2085.
- ↑ Jens F. Peters et al.: The environmental impact of Li-Ion batteries and the role of key parameters – A review. In: Renewable and Sustainable Energy Reviews. Band 67, S. 491–506, doi:10.1016/j.rser.2016.08.039.
- ↑ Erik Emilsson, Lisbeth Dahllöf: Lithium-Ion Vehicle Battery Production. IVL. Abgerufen am 2. Dezember 2019.
- ↑ Linda Ager-Wick Ellingsen: Identifying key assumptions and differences in life cycle assessment studies of lithium-ion traction batteries with focus on greenhouse gas emissions. In: Transportation Research Part D: Transport and Environment. Band 55, 2017, S. 82–90, doi:10.1016/j.trd.2017.06.028.
- ↑ Nikolas Hill, Sofia Amaral, Samantha Morgan-Price, Tom Nokes, Judith Bates, Hinrich Helms, Horst Fehrenbach, Kirsten Biemann, Nabil Abdalla, Julius Jöhrens, Eloise Cotton, Lizzie German, Anisha Harris, Sebastien Haye, Chris Sim, Ausilio Bauen: Determining the environmental impacts of conventional and alternatively fuelled vehicles through LCA. Final Report for the European Commission, DG Climate Action, Contract Ref. 34027703/2018/782375/ETU/CLIMA.C.4. Hrsg.: European Commission. Brüssel 2020, ISBN 978-92-76-20301-8, doi:10.2834/91418.
- ↑ Volkswagen startet Batterie-Recycling in Salzgitter. handelsblatt.com, 29. Januar 2021, abgerufen am 28. Februar 2021.
- ↑ https://www.sonderabfall-wissen.de/wissen/recycling-und-entsorgung-von-e-auto-batterien, abgerufen am 27. Mai 2021.
- ↑ motorradonline.de von 22. Dezember 2020, Zero im Netzwerk für Altbatterien, abgerufen am 27. Mai 2021.
- ↑ a b spektrum.de vom 9. Juni 2020, Die Altlast der Elektromobilität, abgerufen am 13. Juni 2020.
- ↑ https://www.auto-motor-und-sport.de/tech-zukunft/alternative-antriebe/duesenfeld-batterie-recycling-von-elektroautos
- ↑ golem.de vom 28. Mai 2019, Viel zu wertvoll zum Wegwerfen, abgerufen am Mai 2021.
- ↑ Peter Dolega, Matthias Buchert, Johannes Betz: Ökologische und sozio-ökonomische Herausforderungen in Batterie-Lieferketten: Graphit und Lithium. Kurzstudie erstellt im Rahmen des BMBF Verbundprojektes Fab4Lib - Forschung zu Maßnahmen zur Steigerung der Material- und Prozesseffizienz bei der Herstellung von Lithium-Ionen-Batteriezellen entlang der gesamten Wertschöpfungskette (FKZ 03XP0142E). Oeko-Institut e.V., 29. Juli 2020, abgerufen am 18. Oktober 2020.
- ↑ Susanne Götze, Kehrseite der Energiewende, im Deutschlandfunk am 30. April 2019, abgerufen am 9. März 2021.
- ↑ Sascha Zoske: Forschungsprojekt: Was Handy-Akkus mit Wasserknappheit zu tun haben. In: FAZ.NET. ISSN 0174-4909 (faz.net [abgerufen am 23. März 2021]).
- ↑ a b SZ vom 13. März 2019: Warum Lithium aus Akkus immer noch im Müll landet
- ↑ a b c Christian Hanisch, Jan Diekmann, Alexander Stieger, Wolfgang Haselrieder & Arno Kwade: Handbook of Clean Energy Systems – Recycling of Lithium-Ion Batteries. Hrsg.: Jinyue Yan, Luisa F. Cabeza, Ramteen Sioshansi. 5 Energy Storage Auflage. John Wiley & Sons, Ltd, 2015, ISBN 978-1-118-99197-8, Kap. 27, S. 2865–2888, doi:10.1002/9781118991978.hces221.
- ↑ a b c d recyclingnews.de vom 31. Juli 2018, Energie für die Zukunft: Recycling von Lithium-Ionen-Akkus, abgerufen am 10. März 2021.
- ↑ a b c Christian Hanisch, Wolfgang Haselrieder und Arno Kwade: Recycling von Lithium-Ionen-Batterien. 2012, abgerufen am 27. März 2022.
- ↑ a b Recycling of Lithium-Ion Batteries. In: Sustainable Production, Life Cycle Engineering and Management. 2018, ISSN 2194-0541, S. 33, doi:10.1007/978-3-319-70572-9.
- ↑ a b Hellmuth Nordwig: Das mühsame Recycling von Lithium-Ionen-Akkus. In: Forschung aktuell (Rundfunksendung auf DLF). 23. Januar 2019, abgerufen am 10. Oktober 2019.
- ↑ Jung Min-hee: Urban Lithium Mine POSCO Starts Commercial Lithium Production for First Time in the World. Business Korea, 8. Februar 2017, abgerufen am 10. Februar 2017 (englisch).
- ↑ Moon Ji-woong: Posco begins commercial lithium carbonate production in Korea. Pulse News, 7. Februar 2017, abgerufen am 10. Februar 2017 (englisch).
- ↑ Janet Binder: Batterien: Kleine Recycling-Quote. welt.de, 26. Juni 2018, abgerufen am 8. März 2021.
- ↑ Redux: Innovatives Recycling von Lithium-Ionen-Batterien in Bremerhaven geht an den Start. elektroauto-news.net, 10. Juni 2018, abgerufen am 13. März 2021.
- ↑ Wohin mit den alten Akkus der E-Autos? elektroauto-news.net, 10. Januar 2018, abgerufen am 8. März 2021.
- ↑ Matthias Buchert, Jürgen Sutter: Stand und Perspektiven des Recyclings von Lithium-Ionen-Batterien aus der Elektromobilität. Synthesepapier erstellt im Rahmen des vom Bundesministerium für Umwelt, Naturschutz und nukleare Sicherheit geförderten Verbundvorhabens MERCATOR „Material Effizientes Recycling für die Circular Economy von Automobilspeichern durch Technologie ohne Reststoffe“. Hrsg.: Ökoinstitut. Darmstadt 24. August 2020 (oeko.de [PDF; 321 kB]).
- ↑ Lithium-Ionen-Batterien Batterieforum Deutschland (Kompetenznetzwerk Lithium-Ionen-Batterien e. V.)
- ↑ Flyer: Produktübersicht, aufgerufen am 10. Mai 2012.
- ↑ Flyer (NL): Abschnitt: Actieradius (Hinweis auf Verwendung der Lithium-Mangan-Technologie), aufgerufen am 10. Mai 2012.
- ↑ Mehr Reichweite für Elektroautos. Schott AG
- ↑ tietEK: technology concept for inspectation and exploration of the deep sea, Fraunhofer IOSB
- ↑ Altana und CCI kooperieren bei der Entwicklung von Energiespeichersystemen. In: chemanager-online.com, 23. Januar 2014.